Этот закон является законом сохранения энергии в применении к процессам преобразования теплоты.
Обычная запись первого закона термодинамики имеет вид
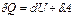 (1.1)
(1.1)
и означает, что теплота 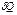 , поглощенная системой из внешней среды, идет па увеличение внутренней энергии
, поглощенная системой из внешней среды, идет па увеличение внутренней энергии 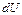 системы и совершение работы
системы и совершение работы 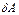 против внешних сил..
против внешних сил..
Работа - любая макрофизическая форма передачи энергии
В общем случае 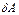 включает работу против сил внешнего давления
включает работу против сил внешнего давления 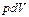 и максимальную полезную работу
и максимальную полезную работу 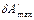 , сопровождающую химические превращения:
, сопровождающую химические превращения:
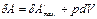
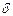 ‑ означает, что теплота и работа не являются функциями состояния системы и не могут быть полными дифференциалами. U ‑ функция состояния системы
‑ означает, что теплота и работа не являются функциями состояния системы и не могут быть полными дифференциалами. U ‑ функция состояния системы 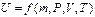 , зависящая от термодинамических параметров
, зависящая от термодинамических параметров 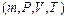 .
.
Работа считается положительной, если она совершается системой.
Теплота процесса — энергия, передаваемая одним телом другому при их взаимодействии, зависящая только от температуры этих тел и не связанная с переносом вещества от одного тела к другому. Работа при этом не совершается. Теплота считается положительной, если энергия поступает в систему, и отрицательной, если энергия отводится от системы.
Внутренняя энергия системы U — функция состояния системы, характеризующаяся тем, что ее приращение в любом процессе равно разности теплоты, сообщенной системе, и работы, coвершенной системой.
Первое начало термодинамики представляет собой закон сохранения энергии в применении к термодинамическим процессам.
Внутренняя энергия представляет собой совокупность всех видов энергии, заключенных в рассматриваемой системе. K ней относятся, например, кинетическая энергия движения молекул, колебательная, вращательная энергия электронного возбуждения. B химических процессах существенную роль приобретает внутренняя энергия, заключающаяся в энергии химических связей, так как направление химического процесса во многом определяется изменением энергии химических связей.
Для адиабатического процесса 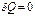 , и поэтому
, и поэтому
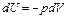
Для изохорного процесса 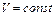 , поэтому
, поэтому 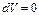 и
и 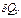 является полным дифференциалом:
является полным дифференциалом:
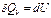
Для изобарного процесса 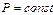 , и поэтому
, и поэтому 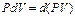 , т.е.
, т.е.
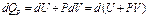
является полным дифференциалом.
Выражению U+PV соответствует функция состояния, которую называют энтальпией (теплосодержанием):
H=U+PV
Количество теплоты, которое поглощается либо выделяется в ходе изобарного процесса, равно изменению энтальпии системы.
Единицей измерения количества теплоты, внутренней энергии, работы и других энергетических величин в системе СИ является Дж или Дж/моль.
Теплоемкость С — отношение количества теплоты dQ, полученного веществом при бесконечно малом изменении его состояния в ком-либо процессе, к изменению температуры dT вещества:
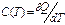
при постоянном давлении:
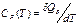
при постоянном объеме:
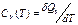
Попытки проверить опытным путем справедливость первого закона термодинамики для биологических веществ принимались давно. Лавуазье и Лаплас (1780) измеряли в ледяном калориметре количество теплоты и CO2, выделяемого организмом морской свинки, а затем сравнивали полученные величины с тепловым эффектом реакции сжигания исходных продуктов питания до CO2.
Такого рода измерения показали, что потребление 1л O2 и выделение 1л CO2 при прямом сжигании или окислении в организме сопровождается выделением 21,2 кДж теплоты. Совпадение тепловых эффектов в обоих случаях и для других реакций свидетельствует о том, что пути превращения продуктов питания в метаболических процессах и в химических реакциях вне живой клетки является эквивалентным с точки зрения суммарных тепловых эффектов. Иными словами, для процессов метаболизма также справедлив известный в физической химии закон Гесса, что дает возможность рассчитывать тепловые эффекты сложных биохимических циклов, если известны лишь начальные и конечные продукты.
Прямые опыты показали, что количество энергии, поглощенной за сутки человеческим организмом вместе с питательными веществами, равно выделенной за это же время теплоте. Этот результат подтверждает справедливость для организмов первого закона термодинамики. Следовательно, сами по себе организмы не являются независимым источником какой–либо новой формы энергии.
 2015-05-13
2015-05-13 275
275








