Самопроизвольное превращение работы в теплоту, сопровождающее неравновесные процессы, связано с переходом упорядоченного, организованного движения частиц системы в беспорядочное, хаотичное движение. Увеличение энтропии при такого рода процессах дает основание усмотреть связь ее со степенью беспорядка в системе. Часто оказывается возможным даже оценить направление изменения энтропии системы на основании только внешних признаков, отражающих степень беспорядка частиц в ней.
Оказывается, что можно установить количественную связь энтропии с так называемой вероятностью состояния системы. Беспорядочное движение частиц, когда в каждый момент для каждой частицы все направления движения в равной мере возможны, является более вероятным движением, чем организованное, вызванное определенными условиями. Это и отражается принципом возрастания энтропии.
 Допустим, имеется два одинаковых сосуда, разделенных краном (рис.). Один из них содержит газ, другой пустой. Если кран открыть, то под действием разности давлений газ распределиться равномерно в обоих сосудах. Можно полагать, что последнее состояние газа, равномерно распределенного в двух сосудах, является более вероятным, чем первое, при котором газ находится в одном сосуде, соединенном с другим при открытом кране.
Допустим, имеется два одинаковых сосуда, разделенных краном (рис.). Один из них содержит газ, другой пустой. Если кран открыть, то под действием разности давлений газ распределиться равномерно в обоих сосудах. Можно полагать, что последнее состояние газа, равномерно распределенного в двух сосудах, является более вероятным, чем первое, при котором газ находится в одном сосуде, соединенном с другим при открытом кране.
Математическая вероятность появления случайного события представляет собой отношение числа случаев, которые благоприятствуют рассматриваемому событию, к числу всех возможных случаев. Если предположить, что вся система, т.е. вещество, находящееся в двух сосудах, состоит из одной молекулы, то, очевидно, вероятность нахождения ее в любом из двух сосудов будет одинакова. Математическая вероятность нахождения молекулы в определенном сосуде будет равна ½. Если система состоит из двух молекул, то легко показать, что имеется один шанс из четырех, что обе молекулы будут обнаружены в определенном сосуде. Таким образом, вероятность такого распределения будет ¼. Из теории вероятностей следует, что вероятность сложного события равна произведению вероятностей простых событий, независимых между собой. Для системы, состоящей из N молекул, вероятность нахождения всех молекул в одном определенном сосуде равна (½)N.
Стремление определить вероятность существования термодинамической системы в данном состоянии привело к понятию термодинамической вероятности. Его можно объяснить следующим образом. Макросостояние системы может быть определено двумя способами: 1) совокупностью макропараметров состояния (давление, температура и т.д.) и 2) совокупностью величин, характеризующих состояние каждой молекулы (координаты, скорость). Другими словами, макросостояние системы может быть определено фиксированием так называемого микросостояния. Одному и тому же макросостоянию может, очевидно, соответствовать очень большое число различных микросостояний. Неизменность макросостояния не означает, следовательно, неизменности микросостояния. В результате хаотического движения молекул и непрерывных их столкновений имеет место непрерывная смена микросостояний и, если они эквивалентны одному и тому же макросостоянию, это состояние остается неизменным.
Термодинамическая вероятность состояния (статистический вес) есть число микросостояний, которые реализует данное макросостояние; это число очень велико. Термодинамическая и математическая вероятности связаны между собой. Впервые связь энтропии S с термодинамической вероятностью состояния W была высказана немецким физиком Л. Больцманом.
Вид аналитической зависимости S=S(W) может быль получен следующим образом. Положим, что две системы имеют энтропии 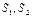 и термодинамические вероятности
и термодинамические вероятности 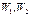 . Объединяя эти системы в одну, можно утверждать, что термодинамическая вероятность ее будет равна произведению вероятностей:
. Объединяя эти системы в одну, можно утверждать, что термодинамическая вероятность ее будет равна произведению вероятностей: 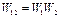 (на основе теории вероятностей), а энтропия – сумме энтропий:
(на основе теории вероятностей), а энтропия – сумме энтропий: 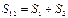 (на основе свойства аддитивности). Отсюда, имея в виду, что
(на основе свойства аддитивности). Отсюда, имея в виду, что
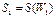 ,
, 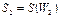 , а
, а 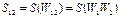 , можно записать
, можно записать
Продифференцировав это выражение по 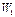 , полагая
, полагая 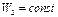 , и по
, и по 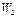 при
при 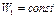 , получим
, получим
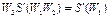 и
и 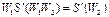 .
.
Умножив первое уравнение на 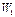 , а второе на
, а второе на 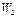 , получим:
, получим:
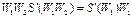 ;
;
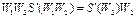 .
.
Приравнивая, имеем
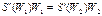 или
или 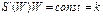
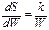
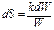
Интегрирование дает
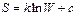
Как показывает дополнительный анализ, коэффициент пропорциональности k в этой формуле есть постоянная Больцмана, не зависящая от свойств вещества. Значение постоянной интегрирования c, как было установлено М.Планком, может быть принято равным нулю. Таким образом, уравнение, связывающее энтропию с термодинамической вероятностью, имеет вид:
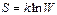
где 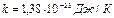 – постоянная Больцмана, равная частному от деления универсальной газовой постоянной на число Авогадро.
– постоянная Больцмана, равная частному от деления универсальной газовой постоянной на число Авогадро.
 2015-05-13
2015-05-13 949
949








