Этот закон устанавливает критерий, отражающий одностороннюю направленность необратимых процессов независимо от их конкретной природы.
Согласно второму закону, состояние системы может быть описано особой функцией состояния - энтропией S. Изменение энтропии dS определяется суммарным значением поглощенных системой приведенных теплот 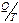 . При бесконечно малом изменении состояния системы изменение энтропии dS равно или больше значения поглощенной системой элементарной приведенной теплоты
. При бесконечно малом изменении состояния системы изменение энтропии dS равно или больше значения поглощенной системой элементарной приведенной теплоты 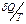 (если процесс носил соответственно равновесный или неравновесный характер):
(если процесс носил соответственно равновесный или неравновесный характер):
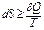
Для системы не совершающей теплообмена с внешней средой, 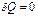 и уравнение принимает вид:
и уравнение принимает вид:
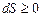
В изолированных системах энтропия остается неизменной в равновесных и возрастает в неравновесных процессах. Это и является критерием направленности превращений в изолированной системе. Таким образом, протекающий в изолированной системе самопроизвольный неравновесный процесс всегда вызывает увеличение энтропии до ее максимальных значений при окончании процесса и установлении термодинамического равновесия.
Изменение энтропии при изменении температуры системы от T1 до T2 в отсутствие фазовых переходов:
При постоянном давлении
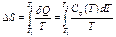
Если зависимостью теплоемкости системы от температуры можно пренебречь, то
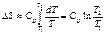
При постоянном объеме
 2015-05-13
2015-05-13 385
385








