Первый и второй законы термодинамики устанавливают существование двух функций состояния системы – внутренней энергии (U) и энтропии (S), приращение которых не зависит от пути перехода из одного состояния в другое. Однако по величине этих функций нельзя судить о величине производимой работы (A). В классической термодинамике доказывается существование других характеристических функций состояния системы, изменение которых в равновесных процессах равно максимальной полезной работе.
В зависимости от условий протекания процесса различают четыре потенциала, которые характеризуются постоянством пары параметров:
| Внутренняя энергия | U | S,V=const |
| Энтальпия | H=U+PV | S,P=const |
| Энергия Гельмгольца (изохорно–изотермический потенциал) | F=U-TS | T,V=const |
| Энергия Гиббса (изобарно–изотермический потенциал) | G=U+PV-TS | T,P=const |
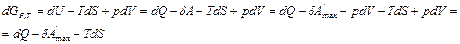
1. для равновесных процессов:
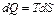
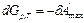 ;
; 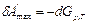
 2015-05-13
2015-05-13 247
247







