Н. Бор пришел к убеждению в том, что планетарная модель атома Э. Резерфорда в основном верна и что законы классической физики неприменимы к внутриатомным процессам. Усовершенствовав модель Э. Резерфорда, Н. Бор создал квантовую теорию строения атома, в основу которой положены три постулата, названные постулатами Бора.
1-й постулат Бора: электроны в атоме могут вращаться вокруг ядра не по любым, а только по разрешенным орбитам, вполне определенного радиуса, определяемого для атома водорода по формуле
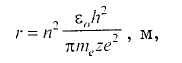
где n — целое положительное число, называемое главным квантовым и обозначающее номер электронной оболочки, n = 1, 2, 3,...; h — постоянная Планка, Дж·с;
2-й постулат Бора: электрон на каждой орбите обладает определенной энергией. Такие орбиты называются стационарными. Движение электронов по стационарным орбитам не сопровождается излучением или поглощением энергии атомом;
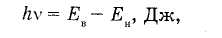 |
3-й постулат Бора: переход электрона с одной стационарной орбиты на другую сопровождается излучением или погло  щением атомом кванта энергии.
щением атомом кванта энергии.
где Ев и Ен — энергия электрона соответственно на верхней и нижней стационарных орбитах, Дж. Очевидно, что частота излучаемых или поглощаемых атомом электромагнитных волн зависит не от частоты вращения электрона в атоме, а от разности энергий разрешенных состояний атома
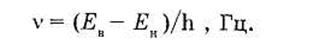
Постулаты Н. Бора излагаются также общей формулировкой: атом устойчив только в стационарных состояниях, соответствующих дискретным разрешенным значениям энергии E1, Е2, Е3,... Переход атома из одного устойчивого энергетического состояния в другое сопровождается излучением или поглощением кванта энергии, определяемого условием частот.
 2015-05-13
2015-05-13 2108
2108
