Литература
Киров - 2009
Твёрдого тела и атомного ядра
Общей физики
Курс
Редкин Ю.Н.
ВЯТСКИЙ ГОСУДАРСТВЕННЫЙ гуманитарный УНИВЕРСИТЕТ
Часть 5. Физика атома,
Печатается по решению Редакционно-издательского совета Вятского государственного гуманитарного университета.
Конспект лекций по курсу общей физики (Часть 5. Физика атома, твёрдого тела и атомного ядра) для студентов высших и средних учебных заведений
Автор:
кандидат физ.-мат. наук, доцент кафедры общей физики ВятГГУ Редкин Ю.Н.
Научный редактор:
кандидат физ.-мат. наук, доцент кафедры общей физики ВятГГУ Бакулин В.Н.
Рецензенты:
кандидат физ.-мат. наук, доцент кафедры общей физики ВятГГУ. Голубев Ю.В.,
кандидат физ.-мат. наук, доцент кафедры физики ВГУ Суслопаров А.М.
Компьютерный набор: Исупов О., Лямин С., Харина В.
Компьютерная верстка - Бакулин В.Н.
© Вятский государственный гуманитарный университет (ВятГГУ) – 2009 г.
физика атома, твёрдого тела и атомного ядра
1. Сивухин Д.В. Общий курс физики. Атомная и ядерная физика. Часть 1. Учебное пособие для студентов вузов. – М.: Наука, 1986. – 416 с.
2. Сивухин Д.В. Общий курс физики. Атомная и ядерная физика. Часть 2. Учебное пособие для студентов вузов. – М.: Наука, 1989. – 415 с.
3. Шпольский Э.В. Атомная физика. Т1. Учебное пособие для студентов вузов. – М.: Наука, 1974. – 575 с.
4. Шпольский Э.В. Атомная физика. Т2. Учебное пособие для студентов вузов. – М.: Наука, 1974. – 447 с.
5. Савельев И.В. Курс физики. Тома 2 и 3. Учебное пособие для студентов вузов. – М.: Наука, 1989.
6. Калашников С.Г. Электричество. Учебное пособие для студентов вузов. – М.: Наука, 1977. – 591 с.
глава 1. Физика атома
1. Закономерности в спектрах атомного водорода. Как известно, есть три вида спектров излучения: сплошной, испускаемый нагретыми твёрдыми и жидкими телами, полосатый, испускаемый молекулярными газами, и линейчатый, испускаемый газами в атомном состоянии. Линейчатые спектры самые простые, они были изучены раньше других.
В 1885 г. швейцарец Иоганн Бальмер исследовал спектр водорода. Оказалось, что в электрическом разряде при давлении не более 10 мм Hgбольшинство молекул водорода диссоциируют на атомы. Спектр, испускаемый атомами водорода, становится более заметным по сравнению с молекулярным.
Измерив длины волн λ спектральных линий, Бальмер нашёл, что они укладываются в формулу: 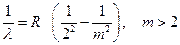 . Формула Бальмера, 1885 (1.1)
. Формула Бальмера, 1885 (1.1)
Здесь m = 3, 4, 5,... ∞ – натуральное число, R – коэффициент пропорциональности, называемый постоянной Ридберга, R = 1,097·107 м–1.
Бальмеру удалось наблюдать 4 линии: H α (m = 3), λ = 656,3 нм, красная; H β (m = 4), λ = 486,1 нм, сине-зелёная; H γ (m = 5), λ = 434,0 нм, фиолетовая; H δ (m = 6), λ = 410,2 нм, фиолетовая. Наблюдать большее число линий в спектре, получаемом с помощью разрядной трубки, трудно по той причине, что газ в трубке сильно разрежён. Из-за этого на пути луча оказывается мало излучающих атомов. Интенсивность света очень низкая, тем более, что с ростом m яркость спектральных линий уменьшается.
С целью повышения интенсивности исследуемый пучок света стали формировать вдоль разрядной трубки, увеличивая её длину до 1-2 м. В 1920 г. Роберт Вуд сфотографировал 22 линии серии Бальмера. Максимальное число линий, 37, удалось сфотографировать в спектре солнечной короны. Здесь водород очень разрежён и находится в атомарном состоянии. За счёт гигантской протяжённости короны интенсивность света достаточно высокая.
Соответствие формулы (1.1) эксперименту поразительно. Расхождения в значениях вычисленных и измеренных λ появляются лишь в 5-6 знаке.
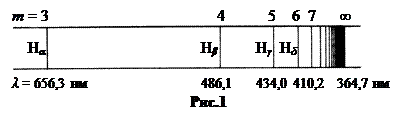 На рис.1 показано расположение линий серии Бальмера в спектре. Примерно так выглядит атомный спектр водорода в спектрометре с дифракционной решёткой. С ростом m линии серии располагаются всё теснее. Минимальная длина волны серии λ = 364,7 нм при m = ∞ называется границей серии.
На рис.1 показано расположение линий серии Бальмера в спектре. Примерно так выглядит атомный спектр водорода в спектрометре с дифракционной решёткой. С ростом m линии серии располагаются всё теснее. Минимальная длина волны серии λ = 364,7 нм при m = ∞ называется границей серии.
Закономерности в спектре атомного водорода долго оставались необъяснимыми. В начале ХХ в. Вальтер Ритц высказал предположение, что в спектре водорода могут быть и другие серии, определяемые формулой (1.1), в которой вместо двойки находятся числа n = 1, 3, 4,..., а m ³ n + 1. В 1906 г. американец Теодор Лайман нашёл подобную серию в ультрафиолетовой области спектра, удовлетворяющую формуле:
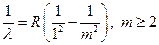 . Серия Лаймана, 1906 (1.2)
. Серия Лаймана, 1906 (1.2)
Позднее были открыты ещё 3 серии в ИК-области.
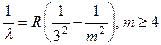 . Серия Пашена, 1908 (1.3)
. Серия Пашена, 1908 (1.3)
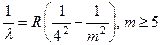 . Серия Брэккета, 1922 (1.4)
. Серия Брэккета, 1922 (1.4)
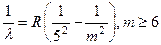 . Серия Пфунда, 1924 (1.5)
. Серия Пфунда, 1924 (1.5)
Все серии объединяются одной обобщённой формулой
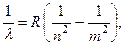 Обобщённая формула Бальмера (1.6)
Обобщённая формула Бальмера (1.6)
где n = 1, 2, 3,..., m = n + 1, n + 2, n + 3,... ∞. В зависимости от n получается та или иная серия.
n = 1, Серия Лаймана, λmax (m = 2) = 121,6 нм, λmin (m = ∞) = 91,2 нм. УФ обл.
n = 2, Серия Бальмера (656,3 – 364,7 нм). Видимая область.
n = 3, Серия Пашена (1875 – 820 нм). Ближняя ИК-область.
n = 4, Серия Брэккета (4051 – 1458 нм). ИК-область.
n = 5, Серия Пфунда (7458 – 2278 нм). Дальняя ИК-область.
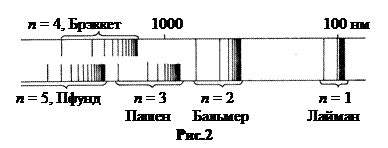 На схеме рис.2 показано относительное положение серий в спектре водорода. Длина волны λ отмечена в логарифмическом масштабе.
На схеме рис.2 показано относительное положение серий в спектре водорода. Длина волны λ отмечена в логарифмическом масштабе.
Как видно из рисунка, только серии Лаймана и Бальмера не перекрываются. Начиная с серии Пашена, с ростом т серии спектральных линий накладываются друг на друга.
В спектре поглощения водорода, атомы которого не возбуждены, присутствует только серия Лаймана. Это объясняется тем, что большинство атомов водорода находятся в основном состоянии, которое соответствует n = 1. (См. след. параграф)..
2. Проблема строения атома. Механическая модель атома как неизменной частицы материи в конце XIX века пришла в прямое противоречие с физическим опытом. В 1887 г. был открыт фотоэффект (выбивание светом из вещества электронов, Г. Герц), в 1895 г. Вильгельм Рентген открывает X-лучи (испускание ЭМ-волн электронами при их быстром торможении о металл), в 1896 г. Антуан Беккерель открывает естественную радиоактивность (испускание атомами проникающего излучения). Стало очевидно, что атом вещества имеет сложную структуру. Встал вопрос: что такое атом и как он устроен?
3. Модель атома Томсона. В 1897 г. Дж. Дж. Томсон, исследуя разряд в разрежённых газах, установил, что от катода к аноду движутся отрицательно заряженные частицы, масса которых примерно в 2000 раз меньше массы атома водорода. Так был открыт электрон.
В 1904 г. Томсон предложил первую атомную модель, пригодную для количественных оценок. Согласно Томсону, атом представляет собой протяжённый шар радиусом R с равномерно и непрерывно распределёнными в нём положительным зарядом. Электроны, входящие в состав атома, находятся внутри этого заряженного шара. Суммарный заряд электронов равен заряду шара, поэтому атом в целом электронейтрален.
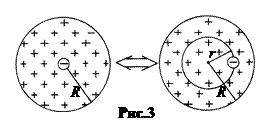 Из модели Томсона вытекал простой механизм излучения атома водорода. Очевидно, заряд шара атома водорода e +, в нём должен находиться один электрон с зарядом e –. В невозбуждённом атоме электрон должен находиться в центре шара (рис.3).
Из модели Томсона вытекал простой механизм излучения атома водорода. Очевидно, заряд шара атома водорода e +, в нём должен находиться один электрон с зарядом e –. В невозбуждённом атоме электрон должен находиться в центре шара (рис.3).
Если электрон сместить из центра на расстояние r, то на него будет действовать электрическая возвращающая сила, равная
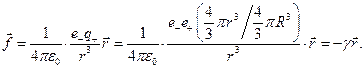 (1.7)
(1.7)
Здесь 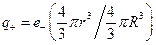 – заряд шаровой области радиуса r £ R,
– заряд шаровой области радиуса r £ R, 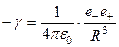 .
.
Возвращающая сила квазиупругая, она пропорциональна смещению r электрона от центра шара. Под действием этой силы электрон способен совершать гармонические колебания x = A cos ω 0 t, где 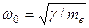 , а me – масса электрона.
, а me – масса электрона.
Ускорение, испытываемое электроном, равно  . Ускоренно движущийся электрон излучает электромагнитную волну той же частоты w 0.
. Ускоренно движущийся электрон излучает электромагнитную волну той же частоты w 0.
Итак, атом водорода по Томсону способен излучать лишь одну монохроматическую ЭМ-волну с частотой w 0. Он не может давать спектральную серию с бесконечным числом длин волн.
Кроме того, модель Томсона не объясняет периодических свойств элементов в таблице Менделеева, природу химической связи, не объясняет a -распад и так далее. Казалось бы, в модели Томсона больше недостатков, чем достоинств. Однако её историческая роль состояла в том, что ею завершался этап догадок и предположений об атомах. Начинались целенаправленные экспериментальные и теоретические исследования.
4. Опыты Ленарда. В 1893 г. Филипп Ленард, изучая катодные лучи, впервые вывел отрицательно заряженные частицы (электроны), движущиеся в разрядной трубке от катода к аноду, через специальное окошко в воздух (рис.4). Окошко Ленарда представляло собой тонкий листок алюминия толщиной 2-3 мкм. Чтобы листок не продавило атмосферным воздухом, он наклеивался на пластинку с отверстиями.
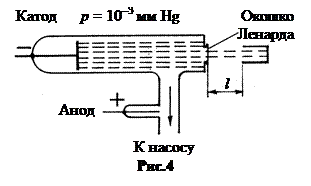 Вылетавшие из разрядной трубки электроны улавливались цилиндром электрометра. Изменяя расстояние l между трубкой и электрометром, можно оценить характер поглощения электронов молекулами воздуха.
Вылетавшие из разрядной трубки электроны улавливались цилиндром электрометра. Изменяя расстояние l между трубкой и электрометром, можно оценить характер поглощения электронов молекулами воздуха.
Оказалось, что электронный пучок ослабляется в воздухе по закону Бугера
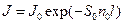 , (1.8)
, (1.8)
где S 0 – эффективное сечение молекул воздуха, рассеивающих электроны, n 0 – концентрация молекул.
Скорость v электронов определяется напряжением U между катодом и анодом и находится из условия: 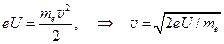 . (1.9)
. (1.9)
Изменяя напряжение на разрядной трубке, Ленард установил, что эффективное сечение молекул воздуха S 0 быстро уменьшается с ростом скорости движения электронов.
После продолжения и углубления опытов в 1903 г. Ленард делает вывод: масса атома не распределена равномерно по его объёму. Она занимает малую часть его объёма.
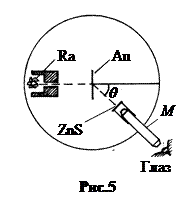 5. Опыты Резерфорда. В 1909 г. Эрнст Резерфорд и его сотрудники Ганс Гейгер и Эрнст Марсден с целью уточнения размеров атомов провели серию опытов. В качестве частиц-снарядов они использовали не электроны, легко отклоняющиеся в электромагнитных полях, а тяжёлые a- частицы – двукратно ионизированные атомы гелия. В отличие от отрицательных ионов a -частицы несут положительный заряд, и потому должны отталкиваться от положительно заряженного ядра атома. Масса a -частицы примерно в 8000 раз больше массы электрона. Поэтому они должны проходить ближе к ядру и позволить тем самым более точно определить его размеры.
5. Опыты Резерфорда. В 1909 г. Эрнст Резерфорд и его сотрудники Ганс Гейгер и Эрнст Марсден с целью уточнения размеров атомов провели серию опытов. В качестве частиц-снарядов они использовали не электроны, легко отклоняющиеся в электромагнитных полях, а тяжёлые a- частицы – двукратно ионизированные атомы гелия. В отличие от отрицательных ионов a -частицы несут положительный заряд, и потому должны отталкиваться от положительно заряженного ядра атома. Масса a -частицы примерно в 8000 раз больше массы электрона. Поэтому они должны проходить ближе к ядру и позволить тем самым более точно определить его размеры.
Установка представляла собой гониометр, на оси которого крепился листок золотой фольги Au (рис.5). Под прямым углом к плоскости фольги на некотором расстоянии от неё находился контейнер с препаратом a -активного радия 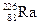 . Вокруг фольги с препаратом почти на полный оборот могла поворачиваться труба микроскопа М. В фокусе объектива микроскопа крепилась стеклянная пластинка с напыленным порошком сульфида цинка ZnS.
. Вокруг фольги с препаратом почти на полный оборот могла поворачиваться труба микроскопа М. В фокусе объектива микроскопа крепилась стеклянная пластинка с напыленным порошком сульфида цинка ZnS.
При попадании a- частицы в кристалл ZnS происходила сцинтилляция – люминесцентная вспышка зеленоватого света, наблюдавшаяся в микроскоп М. Во избежание рассеяния a- частиц на молекулах газа установка герметизировалась и из неё откачивался воздух до давления p < 1 мм Hg. Относительное положение препарата Ra и фольги оставалось в процессе опытов неизменным.
| Таблица 1.1 | |
| θ, º | Число cцинтилляций |
| 132 000 7 800 1 435 |
Измерения сводились к подсчёту числа сцинтилляций при определённых углах θ за одинаковые промежутки времени. Всего было зарегистрировано (визуально!) около 150000 вспышек. В таблице 1.1 приведены результаты измерений рассеяния a- частиц фольгой.
Прежде всего бросается в глаза, что подавляющее большинство a- частиц, взаимодействующих с фольгой, отклоняется в пределах 15º. И лишь ничтожно малая часть (0,05%) отражается под углами 135-150º. Резерфорд предположил, что эти a- частицы отражаются в результате единичных лобовых соударений с ядром.
Для обработки результатов Резерфорд построил количественную теорию рассеяния a- частиц. При этом он полагал, что весь положительный заряд атома Ze + сосредоточен в ядре, а электрическое взаимодействие внутри атома подчиняется закону Кулона. Результаты исследований были опубликованы в 1911 г. По характеру рассеяния a- частиц атомами металлов Резерфорд вычислил размер ядра. Его поперечник оказался в 10 000 раз меньше атома. Для сравнения: радиус Солнца (7·108 м) меньше радиуса орбиты Земли (1,5·1011 м) всего лишь в 210 раз!
Исходя из предположения о справедливости закона Кулона во внутриатомном масштабе, что позволяет заключить, что поле ядра изменяется по Закону E ~ 1 çr 2, Резерфорд предложил ядерную или т.н. планетарную модель атома.
Атом состоит из ядра с зарядом Ze + и вращающихся вокруг него по круговым орбитам Z электронов. Электрическое поле ядра подчиняется закону Кулона.
6. Единичность столкновений. Чтобы убедиться в справедливости гипотезы Резерфорда о единичности соударений a- частиц с ядрами атомов фольги, сравним общую площадь суммарного эффективного сечения ядер атомов фольги с площадью фольги.
Фольга толщиной d и площадью S имеет массу m = ρSd, где ρ – плотность вещества фольги. В этой массе содержится 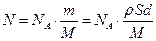 атомов. (1.10)
атомов. (1.10)
Объём одного атома 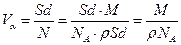 . (1.11)
. (1.11)
Диаметр 2 Ra одного атома есть ребро куба, в который этот атом заключён.
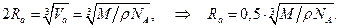 (1.12)
(1.12)
Для золота M = 0,197 кг ç моль, 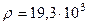 кг ç м3. Отсюда радиус атома
кг ç м3. Отсюда радиус атома 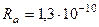 м. Поперечник ядра по расчётам Резерфорда на четыре порядка меньше. Его радиус
м. Поперечник ядра по расчётам Резерфорда на четыре порядка меньше. Его радиус 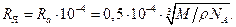 Очевидно,
Очевидно, 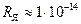 м. (1.13)
м. (1.13)
Площадь эффективного сечения одного ядра 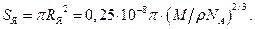 (1.14)
(1.14)
В объёме фольги толщиной d и площадью S суммарное эффективное сечение ядер в N раз больше, 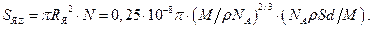 (1.15)
(1.15)
Отношение площади сечения ядер к площади фольги составляет 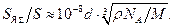 (1.16)
(1.16)
Толщина фольги в опытах Резерфорда не превышала d = 1 мкм. Отсюда S ЯS çS»10-8×10-6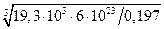 » 4×10-5.
» 4×10-5.
Столь относительно малая площадь суммарного сечения ядер позволяет уверенно говорить о том, что ядра не затеняют друг друга, а повторное соударение a- частицы с ядром исключительно маловероятно. И лишь при движении вдоль фольги эта вероятность увеличивается. Поэтому угол 90º исключён из таблицы.
7. Проблема устойчивости атома Резерфорда. В отличие от статической модели атома Томсона атом Резерфорда динамический. Каждый электрон атома движется вокруг ядра по круговой орбите так, что центростремительная сила равна кулоновской силе притяжения электрона к ядру.  (1.17)
(1.17)
Здесь me – масса электрона, r – радиус его орбиты, Z – зарядовое число ядра, то есть количество в нём элементарных положительных зарядов. Поскольку атом нейтрален, то зарядовое число ядра Z равно числу электронов в атоме.
Если принять, что радиус атома водорода близок к радиусу атома золота, то есть r» 10–10 м, то скорость движения электрона в атоме водорода составляет около 2×106 м ç с. Это вполне классическая скорость, равная 0,7% от скорости света в вакууме.
В ядерной модели Резерфорда внутренняя структура атома приобретала знакомые из небесной механики очертания. Вокруг ядра как вокруг Солнца движутся электроны – планеты. С точки зрения механики система устойчива. В ней действуют только центральные кулоновские силы. Поэтому полная механическая энергия этой, казалось бы, консервативной системы должна оставаться постоянной. И для построения теории атома оставалось лишь применить аппарат классической механики. Но с учётом законов электродинамики планетарный атом неустойчив. Ведь электроны, движущиеся по окружностям, испытывают центростремительное ускорение 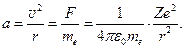 (1.18)
(1.18)
Применительно к атому водорода 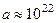 м ç с2. По меркам макрофизики это гигантская величина. Электрический заряд, двигающийся ускоренно, по законам классической электродинамики излучает электромагнитную волну. Энергия ЭМ волны может черпаться лишь из энергии электрона. Но это значит, что радиус орбиты электрона должен постепенно уменьшаться.
м ç с2. По меркам макрофизики это гигантская величина. Электрический заряд, двигающийся ускоренно, по законам классической электродинамики излучает электромагнитную волну. Энергия ЭМ волны может черпаться лишь из энергии электрона. Но это значит, что радиус орбиты электрона должен постепенно уменьшаться.
Расчёты показывают, что вся энергия электрона перейдёт в энергию ЭМ волны за время 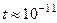 с. Спустя это время электрон должен упасть на ядро, а атом должен превратиться в какой-то другой объект материи.
с. Спустя это время электрон должен упасть на ядро, а атом должен превратиться в какой-то другой объект материи.
Спектр ЭМ излучения, испускаемого электронами такого гибнущего атома, должен быть сплошным, а не линейчатым.
 2014-02-02
2014-02-02 3415
3415







