При недостатке азота в среде обитания тормозится рост растений, ослабляется образование боковых побегов и кущение у злаков, наблюдается мелколистность. Одновременно уменьшается ветвление корней, но соотношение массы корней и надземной части может увеличиваться. Одно из ранних проявлений азотного дефицита — бледно-зеленая окраска листьев, вызванная ослаблением синтеза хлорофилла. Длительное азотное голодание ведет к гидролизу белков и разрушению хлорофилла прежде всего в нижних, более старых листьях и оттоку растворимых соединений азота к более молодым листьям и точкам.роста. Вследствие разрушения хлорофилла окраска нижних листьев в зависимости от вида растения приобретает желтые, оранжевые или красные тона, а при сильно выраженном азотном дефиците возможно появление некрозов, высыхание и отмирание тканей. Азотное голодание приводит к сокращению периода вегетативного роста и более раннему созреванию семян.
 Азот — один из наиболее широко распространенных элементов в природе. Основными его формами на Земле являются связанный азот литосферы и газообразный молекулярный азот (N2) атмосферы, составляющий 75,6% воздуха по массе. Согласно подсчетам запасы N2 в атмосфере оцениваются величиной 4 • 1015 т. Столб воздуха над 1 м2 земной поверхности содержит 8 т азота. Однако молекулярный азот как таковой не усваивается высшими растениями и может переходить в доступную для них форму только благодаря деятельности ми-кроорганизмов-азотфиксаторов.
Азот — один из наиболее широко распространенных элементов в природе. Основными его формами на Земле являются связанный азот литосферы и газообразный молекулярный азот (N2) атмосферы, составляющий 75,6% воздуха по массе. Согласно подсчетам запасы N2 в атмосфере оцениваются величиной 4 • 1015 т. Столб воздуха над 1 м2 земной поверхности содержит 8 т азота. Однако молекулярный азот как таковой не усваивается высшими растениями и может переходить в доступную для них форму только благодаря деятельности ми-кроорганизмов-азотфиксаторов.
Запасы связанного азота в литосфере также значительны и оцениваются величиной 18 • 1015 т. Однако в почве сосредоточена лишь минимальная часть литосферного азота Земли, и только 0,5 — 2% от общего запаса в почве прямо доступно растениям. 1 га пахотного чернозема в среднем содержит не более 200 кг доступного растениям азота, а на подзолах его количество в 3 — 4 раза меньше. Этот азот представлен главным образом в форме NH+4- и NO-3-ионов.
Ионы NOJ подвижны, плохо фиксируются в почве, легко вымываются почвенными водами в более глубокие слои и в водоемы. Содержание нитратов в почве особенно возрастает весной, когда создаются условия, благоприятствующие деятельности нитрифицирующих бактерий. Количество азота NO-3 в почвенном растворе сильно варьирует в зависимости от скорости поглощения нитратов растениями, интенсивности микробиологических процессов и процессов вымывания.
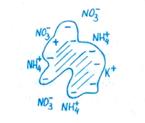 Катион NH+4 менее подвижен, хорошо адсорбируется отрицательно заряженными частицами, меньше вымывается осадками, и поэтому в почвенном растворе его концентрация значительно выше, чем NO-3. В почвах, богатых глинистыми минералами, содержание азота, фиксированного в форме NH+4, может достигать 2 — 3 т/га. В верхних слоях почвы фиксированный азот NH+4 составляет обычно 5 — 6% от общего азота почвы, а в более глубоких слоях, где выше содержание глинистых частиц,— до 20% и более.
Катион NH+4 менее подвижен, хорошо адсорбируется отрицательно заряженными частицами, меньше вымывается осадками, и поэтому в почвенном растворе его концентрация значительно выше, чем NO-3. В почвах, богатых глинистыми минералами, содержание азота, фиксированного в форме NH+4, может достигать 2 — 3 т/га. В верхних слоях почвы фиксированный азот NH+4 составляет обычно 5 — 6% от общего азота почвы, а в более глубоких слоях, где выше содержание глинистых частиц,— до 20% и более.
Растения для своего развития нуждаются в значительных количествах азота. Так, растения кукурузы при среднем урожае зерна 35 ц/га и вегетативной массы 50 ц/га выносят с 1 га около 85 кг азота. Запасы азота в почве могут пополняться разными путями. При возделывании сельскохозяйственных культур много внимания уделяют внесению минеральных удобрений. В естественных* же условиях основная роль принадлежит специализированным группам микроорганизмов. Это уже упомянутые азотфиксаторы, а также почвенные бактерии, способные минерализовать и переводить в форму NH+4 или NO-3 не доступный растениям органический азот растительных и животных остатков и азот гумуса, на долю которых приходится основная часть почвенного азота.
Процесс превращения органического азота почвы в NH+4 носит название аммонификации. Он осуществляется гетеротрофными микроорганизмами и схематически может быть представлен следующим образом:
Органический азот почв→RNН2 + СО2 + побочные продукты RNH2 + Н20 → NH3 + ROH NH3 + H2O→NH4 + OH-
Процессы разложения органического вещества почвы играют чрезвычайно важную роль в обеспечении растений источниками азотного питания. Микробиологическая минерализация органического почвенного азота зависит от условий, благоприятствующих деятельности этих микроорганизмов (оптимальные значения температуры, влажности, рН, аэрированности почвы и ряд других характеристик).
 Биологическое окисление NH3(NH+4) до NO-3, т. е. нитрификация,—это двухступенчатый процесс, осуществляемый двумя специализированными группами автотрофных бактерий — хе-мосинтетиков Nitrosomonas и Nitrobacter, открытых Виноград-ским. Бактерии Nitrosomonas окисляют аммиак до азотистой кислоты в соответствии с уравнением
Биологическое окисление NH3(NH+4) до NO-3, т. е. нитрификация,—это двухступенчатый процесс, осуществляемый двумя специализированными группами автотрофных бактерий — хе-мосинтетиков Nitrosomonas и Nitrobacter, открытых Виноград-ским. Бактерии Nitrosomonas окисляют аммиак до азотистой кислоты в соответствии с уравнением
2NH3 + ЗО2 →2HNO2 + 2Н2О
a Nitrobacter осуществляет дальнейшее окисление азотистой кислоты до азотной:
2НNО2 + О2 → 2НNОз
HNO2 в почве не накапливается, так как обе группы бактерий обычно функционируют последовательно. Благодаря деятельности этих бактерий возникли огромные залежи натриевой селитры (NaNO3) в Чили.
Бактерии- нитрификаторы окисляют не только аммонийный азот органического происхождения, но и NH+3 удобрений, что может привести к вымыванию значительной части внесенного азота в виде легкоподвижного иона NO-3. Чтобы предотвратить этот процесс и дать возможность растениям эффективнее использовать азот удобрений, в последнее время широко применяют ингибиторы нитрификации. Наиболее известный из них — «N-serve», или 2-хлор-6(трихлорметил)- пиридин. Внесение ингибиторов препятствует избыточному накоплению в некоторых сельскохозяйственных растениях (шпинате, салате и др.) иона NO-3, в количествах, токсичных для человека и животных.
Содержание в почве доступного растениям азота определяется не только микробиологическими процессами минерализации органического азота и азотфиксации, а также скоростью поглощения азота растениями и его вымыванием из почвы, но и потерями азота в процессе денитрификации, осуществляемой анаэробными микроорганизмами, способными восстанавливать ион NO-3 до газообразного N2. Этот процесс особенно интенсивно протекает во влажных затопляемых слабоаэрируемых почвах, в частности на рисовых полях.
Таким образом, азот — очень лабильный элемент, циркулирующий между атмосферой, почвой и живыми организмами. Основные процессы, связанные с круговоротом азота в биосфере, показаны на рис. 6.1.

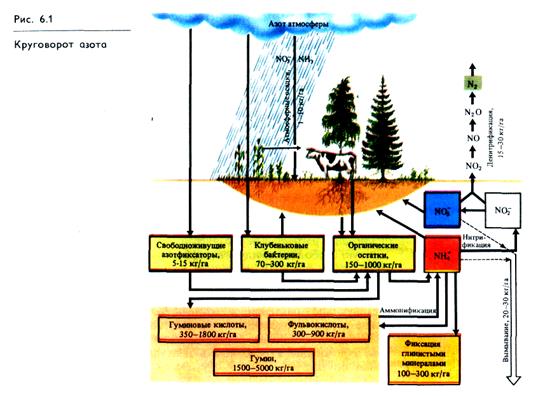
Химический и биологический пути связывания молекулярного
азота.В природе существуют два пути превращения N2 в доступную растениям форму. Это химическая и биологическая азотфиксация. Химическое связывание N2 в форме ионов NH+4 или NO-3 в небольших размерах осуществляется в результате фотохимических процессов и электрических разрядов в атмосфере. Количество связанного азота, попадающего при этом в почву с атмосферными осадками, сравнительно невелико и в различных районах земного шара колеблется в пределах 1 — 30 кг/га за год.
В настоящее время в ряде стран больших масштабов достигло промышленное производство HNO3 и NH3 из азота воздуха. Химическое связывание молекулярного азота с образованием аммиака (N2 + ЗН2 → 2NH3) осуществляется в присутствии катализаторов при температуре свыше 500°, давлении около 35 МПа и составляет основу синтеза аммонийных удобрений.
Однако азот минеральных удобрений восполняет лишь часть того азота, который выносится с урожаем. Основная масса азота, содержащегося в населяющих нашу планету живых организмах, своим происхождением обязана деятельности уникальной группы микроорганизмов, способных ассимилировать молекулярный азот атмосферы, восстанавливая его в NH3, и тем самым делать его доступным для высших растений (и далее — животных).
Процесс связывания молекулярного азота атмосферы, осуществляемый этими организмами, носит название диалогической азотфиксации. Общая мировая биологическая фиксация азота составляет около 17,2 • 107 т в год, что в настоящее время в 4 раза превышает химическое связывание N2 в форме NH3 на предприятиях химической индустрии.
 Азот фиксирующие микроорганизмы. Микроорганизмы, осуществляющие биологическую азотфиксацию, можно разделить на две основные группы: а) свободноживущие азотфиксаторы и б) микроорганизмы, живущие в симбиозе с высшими растениями.
Азот фиксирующие микроорганизмы. Микроорганизмы, осуществляющие биологическую азотфиксацию, можно разделить на две основные группы: а) свободноживущие азотфиксаторы и б) микроорганизмы, живущие в симбиозе с высшими растениями.
Впервые анаэробная спороносная свободноживущая бактерия, способная к фиксации N2, была выделена русским ученым С. Н. Виноградским в 1893 г. и названа им в честь Л. Пастера Clostridiwn pasteurianum. Позднее, в 1901 г., М. Бейеринк открыл другую свободноживущую азотфиксирующую аэробную бактерию — A:otobacter. В настоящее время группа свободноживущих азотфиксаторов включает бактерии родов Azotobacter и Beijerinckia, некоторые штаммы Clostridium, а также фотосинтезирующие бактерии и отдельные виды цианобактерий (синезеленых водорослей). За исключением Azotobacter и Beijerinckia, остальные представители этой группы анаэробы, обитающие в основном в неокультуренных малоаэрируемых почвах.
Свободноживущие азотфиксаторы — гетеротрофы, нуждаются в углеводном источнике питания и поэтому часто связаны с микроорганизмами, способными к разложению целлюлозы и других полисахаридов. Бактерии родов Azotobacter и Beijerinckia, как правило, поселяются на поверхности корней высших растений. Такие ассоциации объясняются тем, что в качестве источника углерода бактерии используют продукты, выделяемые корнями в ризосферу.
 Большое внимание в последнее время уделяют цианобакте-риям, в частности Tolypothrix tenius. Обогащение ими рисовых полей увеличивает урожай риса в среднем на 20%. В целом же сельскохозяйственное значение свободноживущих азотфиксаторов не столь велико. В умеренном климате ежегодная фиксация ими азота составляет, как правило, несколько килограммов азота на 1 га, но при наличии в почве благоприятных условий (например, большое количество органических остатков) она может достигать 20 — 40 кгМ/га.
Большое внимание в последнее время уделяют цианобакте-риям, в частности Tolypothrix tenius. Обогащение ими рисовых полей увеличивает урожай риса в среднем на 20%. В целом же сельскохозяйственное значение свободноживущих азотфиксаторов не столь велико. В умеренном климате ежегодная фиксация ими азота составляет, как правило, несколько килограммов азота на 1 га, но при наличии в почве благоприятных условий (например, большое количество органических остатков) она может достигать 20 — 40 кгМ/га.
К группе симбиотических азотфиксаторов прежде всего относятся бактерии рода Rhizobium, образующие клубеньки на корнях бобовых растений, а также некоторые ак-тиномицеты и цианобактерий. В настоящее время насчитывается около 190 видов растений разных семейств, способных симбиотически усваивать азот. К их числу относятся некоторые деревья и кустарники: ольха, восковница, лох, облепиха и др. Клубеньки, вырастающие на корнях ольхи и некоторых других небобовых растений, населены актиномицетами рода Frankia.
 Роща молодой ольхи за 7лет дает прирост азота 700 кг/га, что значительно обогащает лесную почву. У некоторых тропических деревьев и кустарников клубеньки развиваются на листьях. У травянистых растений рода Gunnera клубеньки на листьях образуют азотфиксирующие цианобактерии рода Nostoc.
Роща молодой ольхи за 7лет дает прирост азота 700 кг/га, что значительно обогащает лесную почву. У некоторых тропических деревьев и кустарников клубеньки развиваются на листьях. У травянистых растений рода Gunnera клубеньки на листьях образуют азотфиксирующие цианобактерии рода Nostoc.
Важное значение в природе имеют некоторые лишайники, представляющие собой симбиоз гриба и азотфиксирующих цианобактерии. Они развиваются в субарктических зонах, на скалах в горах и на других бесплодных участках, являясь, таким образом, пионерами заселения суши.
Наибольший интерес для сельского хозяйства представляют клубеньковые бактерии рода Rhlzobium, живущие в симбиозе с бобовыми растениями и фиксирующие в среднем от 100 до 400 кгN/га в год. Среди бобовых культур люцерна может накопить за год до 500 — 600 кгN/гa, клевер — 250 —300, люпин — 150, кормовые бобы, горох, фасоль — 50 — 60 кгN/гa. За счет пожнивных остатков и сидерации' эти растения значительно обогащают почвы азотом.
Инфицирование растения-хозяина начинается с проникновения бактерий рода Rhizobium в клетку корневого волоска. Затем бактерии мигрируют в клетки коры и вызывают интенсивное деление инфицированных клеток, что приводит к образованию клубеньков на корнях. При этом сами бактерии превращаются в бактероиды, которые в среднем в 40 раз больше по объему, чем исходная бактерия. Образование бактероидов тесно связано с синтезом нитрогеназной ферментативной системы. В сельскохозяйственной практике семена бобовых культур обрабатывают препаратом «Нитрагин» с высокоэффективным штаммом расы клубеньковых батстерий, соответствующей данной бобовой культуре.
Молекулярный механизм азотфиксации. Молекула азота N2(N???N) чрезвычайно прочна и химически инертна. Энергия трех ее ковалентных связей составляет 940 кДж/моль. Для разрыва этих связей и восстановления N2 в химическом процессе синтеза аммиака, несмотря на применение катализаторов, требуются, как уже отмечалось, высокие температура и давление. Биологическая фиксация N2 микроорганизмами осуществляется при нормальной температуре и давлении, что свидетельствует об исключительно высокой эффективности участвующего в этом процессе фермента нитрогеназы.
В 1960—1961 гг. на бесклеточных экстрактах Clostridium pas-teurianum было показано, что особую роль в азотфиксации играет добавление пировиноградной кислоты. При этом резко усиливалось выделение СО2 и Н2. В присутствии молекулярного азота в качестве первичного продукта образовывался аммиак. Большое значение в выяснении механизма азотфиксации сыграло открытие ферредоксина. На основании этих данных была предложена следующая схема химизма азотфиксации:
1 Сидерация — запахивание зеленых растений, обычно бобовых, используемых в качестве удобрения.
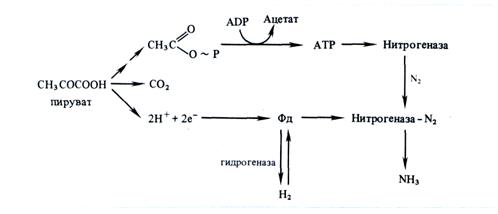
Многочисленными исследованиями с применением меченого 15N было доказано, что азотфиксация представляет собой восстановительный процесс и первым стабильным продуктом ее действительно является аммиак. Предполагают, что восстановление N2 осуществляется трехступенчато (рис. 6.2).
Процессу азотфиксации необходим постоянный приток электронов и энергии в форме АТР. Согласно расчетам, проведенным на основе модельных опытов в системе in vitro, для восстановления 1 моля N2 требуется 12—15 молей АТР. Действительные же затраты энергии в системе in vivo значительно выше и оцениваются в 30 — 40 молей АТР на 1 моль фиксированного N2.Источником электронов и АТР для функционирования нитрогеназы у разных типов микроорганизмов могут быть процессы фотосинтеза, дыхания или брожения. Например, свободноживущие бактерии Azotobacter для восстановления 1 г N2 окисляют 70—100 г глюкозы, или 28 — 40 г углерода. Симбиотрофные бактерии рода Rhizobium в качестве источников электронов и АТР используют фотоассимиляты, синтезирующиеся в листьях растения-хозяина и поступающие в корневые клубеньки.
Расход ассимилятов у бобовых на 1 г фиксированного N2) составляет в среднем 6,5 — 7,6 г углерода, т. е. эффективность использования энергетических субстратов у них значительно выше (10—15%), чем у свободноживущих гетеротрофов (1,5-2,0%).
Основные черты биохимии азотфиксации достаточно хорошо изучены в последние годы. По-видимому, механизм азот-фиксации одинаков для всех азотфиксирующих микроорганизмов. Упрощенная схема азотфиксации, включающая основные реакции этого процесса, приведена на рис. 6.3.
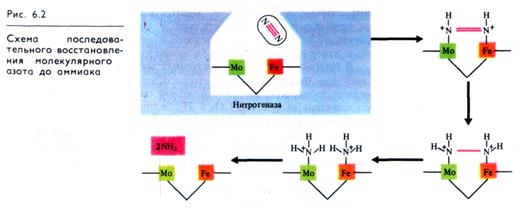
Процесс протекает в бактероиде, окруженном мембраной и локализованном в кортикальных клетках корня растения-хозяина. Основная роль в процессе азотфиксации принадлежит ферменту нитрогеназе, который подробнее изучен у свободно- живущих азотфиксаторов. Фермент состоит из двух компонентов: более высокомолекулярного Мо, Fe-белка и низкомолекулярного Fe-белка. Азотфиксирующей активностью обладает только комплекс обоих компонентов нитрогеназы. Мо, Fe-белок различных нитрогеназ имеет Мr ≈ 200 — 250 тыс., содержит два атома Мо, 28 — 34 атома Fe и 18 — 24 атома лабильной S на молекулу, причем Fe и S объединены в несколько FeS-класте-ров. Низкомолекулярный компонент нитрогеназы, Fe-белок, имеет Mr ~ 50-70 тыс., содержит по четыре атома Fe и лабильной S на молекулу фермента, которые объединены в кластер типа 4Fe4S. Субстрат (N2) связывается и восстанавливается на Мо, Fe-белке, а Fe-белок служит источником электронов для восстановления Мо, Fe-белка, которые он получает от ферре-доксина (Фд). Комплекс двух компонентов нитрогеназы существует лишь во время сопряженного с гидролизом АТР переноса электронов от Fe-белка к Мо, Fe-белку.
Нитрогеназа катализирует три типа сопряженных реакций: восстановление субстратов, зависимый от восстановителя гидролиз АТР и АТР-зависимое выделение Н2. Кроме молекулярного азота она может восстанавливать и другие соединения с тройной связью, в том числе азид, цианид, ацетилен.
Поскольку нитрогеназа разрушается в присутствии О2, у азотфиксирующих микроорганизмов используется ряд механизмов для ее защиты. У Rhizobium эту функцию выполняет гемсодержащий белок легоглобин (леггемоглобин), обладающий очень высоким сродством к кислороду.
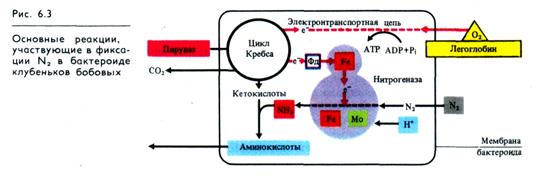
 Он синтезируется клетками растения-хозяина, встраивается в мембрану бактероида и обеспечивает транспорт О2 к бактероидам, создавая таким образом защиту нитрогеназы от повреждающего действия О2. Функционирующий в бактероиде цикл Кребса служит источником субстратов для окисления в электронтранспортной цепи, осуществляющей синтез АТР; обеспечивает нитрогеназу электронами через ферредоксин; поставляет кетокислоты (α-ке-тоглутарат и др.), которые, реагируя с NH+4, образуют аминокислоты, транспортируемые затем в клетки растения-хозяина.
Он синтезируется клетками растения-хозяина, встраивается в мембрану бактероида и обеспечивает транспорт О2 к бактероидам, создавая таким образом защиту нитрогеназы от повреждающего действия О2. Функционирующий в бактероиде цикл Кребса служит источником субстратов для окисления в электронтранспортной цепи, осуществляющей синтез АТР; обеспечивает нитрогеназу электронами через ферредоксин; поставляет кетокислоты (α-ке-тоглутарат и др.), которые, реагируя с NH+4, образуют аминокислоты, транспортируемые затем в клетки растения-хозяина.
Поскольку в органические соединения включается только аммонийный азот, ионы нитрата, поглощенные растением, должны восстанавливаться в клетках до аммиака. Каким образом происходит это восстановление?
Установлено, что процесс редукции нитрата в растениях осуществляется в два этапа:
1. Восстановление нитрата до нитрита (NO-3 до NO-2), сопряженное с переносом двух электронов и катализируемое ферментом нитратредуктазой.
2. Восстановление нитрита до аммиака (NO-2 до NH+4), сопряженное с переносом шести электронов и катализируемое ферментом нитритредуктазоп.
Суммарно процесс может быть изображен следующим образом:
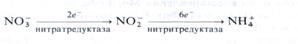
Первый этап редукции нитрата, катализируемый нитратре-дуктазой, протекает в соответствии с уравнением

Грибы и зеленые водоросли в качестве донора электронов при редукции NO-3 могут использовать восстановленный NADPH. У высших растений фермент имеет специфическое сродство к NADH, источником которого являются гликолиз и цикл Кребса.
Нитратредуктаза представляет собой гем- и молибденсо-держащий флавопротеин с Mr ≈ 200 — 300 тыс. Он состоит из двух субъединиц, последовательно участвующих в переносе электрона от NADH к NO-3 : диафоразной, содержащей в качестве простетической группы FAD и катализирующей перенос е от NADH к цитохрому 6557, и терминальной, содержащей Мо и непосредственно участвующей в связывании нитрата и переносе на него электрона. Путь переноса е- от NADH к NO-3, осуществляемый нитратредуктазой, может быть представлен следующим образом:
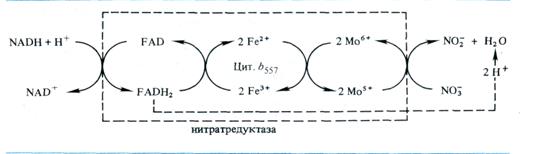
Экспериментально установлено, что нитратредуктаза локализована в цитоплазме. Однако высказано предположение, что фермент может быть ассоциирован с мембранами — плазма-леммой или мембраной хлоропластов, на которых он удерживается непрочными связями, легко разрушаемыми при выделении структур.
Нитратредуктаза — индуцируемый фермент, синтезируемый в клетке в ответ на поступление NО-3. Индуктором синтеза фермента у растений способны быть также органические нитро-соединения и цитокинин. Уровень нитратредуктазы в растениях зависит от ряда факторов внешней среды, таких, как свет, температура, рН, концентрация СО2 и О2, водный потенциал, характер источника азота и др. При слабой освещенности активность нитратредуктазы в фотосинтезирующих тканях низка, что может вести к накоплению в листьях свободных неассимилированных ионов NO-3. Активность нитратредуктазы высока в меристематических клетках, ею богаты молодые листья и кончики корней.
 Нитриты, образующиеся на первом этапе редукции нитратов, в растении не накапливаются, а быстро восстанавливаются до аммиака ферментом нитритредуктаюй. Активность этого фермента в 5 —20 раз выше, чем нитратредуктазы, поэтому в общем процессе редукции нитратов доминирующей ступенью является первый этап реакции, ведущий к образованию NО-2. Нитритредуктаза в качестве донора электронов использует восстановленный ферредоксин. Катализируемая ею реакция может быть представлена следующим образом:
Нитриты, образующиеся на первом этапе редукции нитратов, в растении не накапливаются, а быстро восстанавливаются до аммиака ферментом нитритредуктаюй. Активность этого фермента в 5 —20 раз выше, чем нитратредуктазы, поэтому в общем процессе редукции нитратов доминирующей ступенью является первый этап реакции, ведущий к образованию NО-2. Нитритредуктаза в качестве донора электронов использует восстановленный ферредоксин. Катализируемая ею реакция может быть представлена следующим образом:
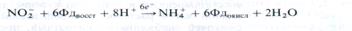
Нитритредуктаза — относительно низкомолекулярный белок с Мr ≈ 60 — 70 тыс., включающий около 600 аминокислотных остатков. Фермент содержит железопорфириновую простетиче-скую группу (она же компонент сульфитредуктазы) и железо в виде кластера 4Fe4S (являющегося также кластером сульфитредуктазы). Установлено, что перенос шести электронов катализируется одним ферментом, NO-2 восстанавливается до NH+4 без накопления свободных промежуточных соединений типа гипонитрита (HNO)2 и гидроксиламина NH2OH.
Процесс редукции NO-2, катализируемый нитритредуктазой, как и первый этап восстановления нитрата, может происходить и в листьях, и в корнях.
В зеленых частях растения нитритредуктаза локализована в хлоропластах. При этом восстановитель — ферредоксин получает электроны прямо из фотосинтетической электрон-транспортной цепи.
В корнях NO-2 восстанавливается в пропластидах, однако природа этого восстановителя остается не ясной, так как ферредоксин в корнях отсутствует. Возможно, источником электронов в корнях служит NADPH, образующийся в пенто-зофосфатном пути дыхания, а также при декарбоксилировании.
Ионы аммония ингибируют ассимиляцию NO-3, репрессируя синтез ферментов нитрат- и нитритредуктаз по принципу обратной связи.
Восстановление нитратов у растений может осуществляться и в листьях, и в корнях, однако относительная доля участия этих органов в редукции нитратов у растений разных видов сильно варьирует. По этому признаку растения подразделяют на три основные группы:
1. Растения, практически полностью восстанавливающие нитраты в корнях и транспортирующие азот к листьям в органической форме. К этой группе относятся многие древесные растения, а также некоторые представители сем. Ericaceae и Vacciniaceae (черника, клюква), многие виды Rhododendron.
2. Растения, практически не проявляющие нитратредуктаз-ной активности в корнях и ассимилирующие нитраты в листьях. Это дурнишник (Xanthium), некоторые виды Borago. К этой группе примыкают хлопчатник и представители сем. Chenopo-diaceae (свекла, марь), у которых основное количество поглощенного нитрата восстанавливается в листьях.
3. Растения, способные поддерживать активность нитрат-редуктазы и в листьях, и в корнях. Это наиболее многочисленная группа, к которой относится большинство травянистых растений, в том числе злаковые, бобовые, многие технические и сельскохозяйственные культуры. У этих растений редукция нитратов, как правило, активнее протекает в листьях, например у томатов, огурцов, табака, однако соотношение восстановленных и окисленных форм азота в корнях и надземной части растений в определенной степени может быть функцией снабжения их нитратами, поскольку с увеличением доступности нитратов прогрессивно большая часть NO-3 поступает в побег.
 Ассимиляция нитратов в листьях на свету тесно связана с процессом фотосинтеза. Реакции фотосинтеза используются как источник АТР для синтеза нитрат- и нитритредуктазы и транспорта нитратов, а также как источник восстановителей (для функционирования этих ферментов) и субстрата (органических кислот) для связывания конечного продукта восстановления — аммиака.
Ассимиляция нитратов в листьях на свету тесно связана с процессом фотосинтеза. Реакции фотосинтеза используются как источник АТР для синтеза нитрат- и нитритредуктазы и транспорта нитратов, а также как источник восстановителей (для функционирования этих ферментов) и субстрата (органических кислот) для связывания конечного продукта восстановления — аммиака.
Аммиак, поступивший в растение извне, образовавшийся при восстановлении нитратов или в процессе фиксации молекулярного азота, далее усваивается растениями с образованием различных аминокислот и амидов. Аммиак может ассимилироваться путем аминирования или амидирования целого ряда соединений, однако ведущая роль в процессе первичного связывания аммиака у высших растений принадлежит реакциям биосинтеза глутаминовой кислоты и ее амида — глутамина.
Один из возможных способов ассимиляции аммония в растениях — восстановительное аминирование α-кетоглутаровой кислоты, катализируемое ферментом глутаматдегидрогеназой (ГДГ) и ведущее к образованию глутаминовой кислоты:
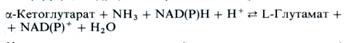
На первом этапе реакции субстраты соединяются с образованием иминокислоты, которая далее восстанавливается в глутамат при участии NAD(P)H. Обе ступени обратимы и могут быть представлены следующим образом:
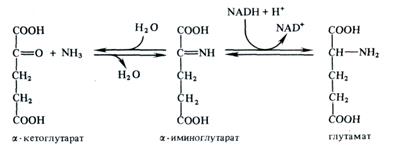
Глутаматдегидрогеназа обнаружена практически у всех высших растений. Она присутствует и в листьях, и в корнях, однако в корнях активность этого фермента, как правило, значительно выше. Фермент локализован преимущественно в митохондриях, хотя имеется также в цитозоле и хлоропластах, где его активность в несколько раз ниже. Полагают, что ГДГ корней и митохондриальная ГДГ NADH-зависимы, тогда как в хлоропластах ГДГ специфична к NADPH. Растительные ГДГ имеют Мr ≈ 200-300 тыс. и состоят из 4-6 субъединиц. Обнаружено до 13 изоформ ГДГ. Это фермент обратимого действия. Соотношение аминирующей и дезаминирующей активности ГДГ митохондрий сильно зависит от соотношения NAD+/ NADH и уровня рН. Оптимум рН для аминирования на 1 — 1,5 единицы ниже, чем для дезаминирования.
|
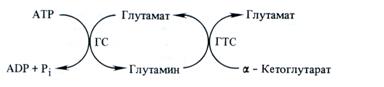
Благодаря исследованиям Р. Ли и Б. Мифлина (1974) был открыт основной путь первичной ассимиляции аммония, включающий две последовательные сопряженные реакции, катализируемые ферментами глутаминсинтетазой (ГС) и глута-матсинтазой (ГТС):
Таким образом в клетках образуется не только глута-линовая кислота, но и глутамин:
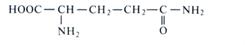
Глутаминсинтетаза катализирует реакцию, в которой глу-тамат функционирует как акцептор NH, для образования глу-тамина. Для этой реакции требуется АТР. Причем ГС обладает гораздо большим сродством к NH3, чем ГДГ.
Глутаматсинтаза катализирует реакцию переноса амидной группы глутамина на α-кетоглутарат в присутствии восстановителя (ферредоксина или NADPH) с образованием двух молекул глутамата.
Двухвалентные катионы металлов (Mg2 +, Мп2 +, Со2 +, Са2 +) играют ключевую роль в проявлении каталитических свойств ГС. Наивысшая активность ГС наблюдается при использовании Mg2+ в качестве кофактора. Работами В. Л. Кретовича с сотрудниками установлено, что ГС из листьев гороха и тыквы имеетМr в пределах 370 — 520 тыс. Фермент обнаружен во всех органах растений. В листьях фермент локализован преимущественно в цитозоле, хотя может находиться в хлоропластах. В корнях высших растений ГС найдена в цитозоле. Вопрос о возможности ее локализации в митохондриях не выяснен.
 Глутаматсинтаза обнаружена в листьях и корнях высших растений. В корнях этот фермент NADPH-зависим, в листьях донором электронов для ГТС служит ферредоксин. Мr фермента 145—180 тыс. В зеленых частях растения Глутаматсинтаза локализована преимущественно в хлоропластах.
Глутаматсинтаза обнаружена в листьях и корнях высших растений. В корнях этот фермент NADPH-зависим, в листьях донором электронов для ГТС служит ферредоксин. Мr фермента 145—180 тыс. В зеленых частях растения Глутаматсинтаза локализована преимущественно в хлоропластах.
 2015-05-26
2015-05-26 2002
2002








