| Плотность, г/см3 | Концентрация, % | Плотность, г/см3 | Концентрация, % | Плотность, г/см3 | Концентрация, % |
| 1,0154 | 1,0542 | 1,0700 | |||
| 1,0168 | 1,0551 | 1,0699 | |||
| 1,0182 | 1,0559 | 1,0698 | |||
| 1,0195 | 1,0567 | 1,0696 | |||
| 1,0209 | 1,0575 | 1,0693 | |||
| 1,0223 | 1,0582 | 1,0689 | |||
| 1,0236 | 1,0590 | 1,0685 | |||
| 1,0250 | 1,0597 | 1,0680 | |||
| 1,0263 | 1,0604 | 1,0676 | |||
| 1,0276 | 1,0611 | 1,0668 | |||
| 1,0288 | 1,0618 | 1,0661 | |||
| 1,0301 | 1,0624 | 1,0652 | |||
| 1,0313 | 1,0631 | 1,0643 | |||
| 1,0326 | 1,0637 | 1,0632 | |||
| 1,0338 | 1,0642 | 1,0619 | |||
| 1,0349 | 1,0648 | 1,0605 | |||
| 1,0361 | 1,0653 | 1,0588 | |||
| 1,0372 | 1,0658 | 1,0570 | |||
| 1,0384 | 1,0662 | 1,0549 | |||
| 1,0395 | 1,0666 | 1,0524 | |||
| 1,0406 | 1,0671 | 1,0498 | |||
| 1,0417 | 1,0675 | ||||
| 1,0428 | 1,0678 |
9.3.2. Определение концентрации кислоты химическим способом
Данный способ основан на способности уксусной кислоты взаимодействовать с гидроксидами щелочных металлов. В результате нейтрализации уксусной кислоты щелочью в присутствии фенолфталеина образуется соль уксусной кислоты и вода. В точке нейтрализации происходит изменение окраски от бесцветной до слаборозовой.
|
|
|
 CH3COOH + NaOH CH3COONa + H2O
CH3COOH + NaOH CH3COONa + H2O
Проведение испытания:
В предварительно взвешенную с точностью до 0,001 г коническую колбу с пробкой емкостью 50-100 мл, содержащую 5 мл дистиллированной воды, вносят 1 мл исследуемой уксусной кислоты, закрывают пробкой и взвешивают. Затем в колбу приливают 20 мл дистиллированной воды, перемешивают и титруют 1 н раствором гидроксида натрия в присутствии фенолфталеина.
Концентрацию уксусной кислоты (У) в % определяют по формуле:
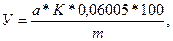
где a – количество 0,1 н раствора щелочи, израсходованного на титрование, мл;
К – поправочный коэффициент для 0,1 н раствора щелочи;
0,06005– количество уксусной кислоты, эквивалентное 1 мл 1 н раствора щелочи, г;
m – масса навески уксусной кислоты, г.
Вычисление проводят с точностью до 0,1 %.
9.4.Определение присутствия минеральных кислот и их солей.
Методы определения присутствия серной и соляной кислот и их солей в уксусной кислоте основаны на способности кислотных остатков взаимодействовать с ионами бария и серебра с образованием минеральных осадков.
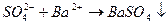
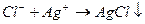
Проведение испытания:
Проба на серную кислоту. 2 мл пищевой уксусной кислоты или 1 мл кислоты другой марки (очищенная, техническая) разбавляют дистиллированной водой в соотношении 1:10 (техническую кислоту в соотношении 1:20) и прибавляют несколько капель 10%-го раствора хлорида бария.
Проба на соляную кислоту. 2 мл пищевой уксусной кислоты или 1 мл кислоты другой марки (очищенная, техническая) разбавляют дистиллированной водой в соотношении 1:10 (техническую кислоту в соотношении 1:20) и прибавляют несколько капель 10%-го раствора нитрата серебра.
|
|
|
В обоих случаях не допускается помутнения в пищевой и очищенной кислоте и осадка – в технической кислоте.
9.5. Определение присутствия солей тяжелых металлов.
9.5.1. Определение присутствия солей меди.
Метод основан на том, что аммиакат меди, образующийся при взаимодействии ионов меди с избытком аммиака, имеет голубой цвет.
 CН3СООН + NH4OH + Cu2+ [Cu(NH3)4]2+ +
CН3СООН + NH4OH + Cu2+ [Cu(NH3)4]2+ + 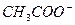 + H2O
+ H2O
Проведение испытания:
25 мл пищевой или очищенной уксусной кислоты выпаривают в фарфоровой чашке до 1/10 первоначального объема и приливают с избытком аммиак. Голубого окрашивания раствора не допускается.
9.5.2. Определение присутствия солей свинца
Метод основан на том, что ионы свинца, вступая в реакцию с кислотным остатком разбавленной серной кислоты, образуют сульфат свинца. Для уменьшения растворимости этой соли в воде и, следовательно, увеличения чувствительности реактивов, в раствор добавляют этиловый спирт.
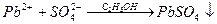
Проведение испытания:
3 мл пищевой или очищенной уксусной кислоты и 5 мл этилового спирта наливают в пробирку и добавляют несколько капель серной кислоты. Появление помутнения не допускается.
© Нина Ивановна Егорова
Олег Владимирович Яковлев
 2015-10-16
2015-10-16 326
326







