I. Щелочные металлы.
Щелочные металлы легко реагируют с неметаллами:
2K + I2 = 2KI
2Na + H2 = 2NaH
6Li + N2 = 2Li3N (реакция идет уже при комнатной температуре)
3K + P = K3P
2Na + S = Na2S
2Na + 2C = Na2C2
В реакциях с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – пероксид, калий – надпероксид.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
K + O2 = KO2
Получение оксида натрия:
10Na + 2NaNO3 = 6Na2O + N2 ↑
2Na + Na2O2 = 2Na2O
2Na + 2NaOН = 2Na2O + Н2↑
Взаимодействие с водой приводит к образованию щелочи и водорода.
2Na + 2H2O = 2NaOH + H2↑
Взаимодействие с кислотами:
2Na + 2HCl = 2NaCl + H2↑
8Na + 5H2SO4(конц.) = 4Na2SO4 + H2S + 4H2O
2Li + 3H2SO4(конц.) = 2LiHSO4 + SO2 + 2H2O
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
При взаимодействии с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
Взаимодействие с органическими соединениями:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
2CH3Cl + 2Na → C2H6 + 2NaCl
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2СН3ОН + 2Na → 2 CH3ONa + H2↑
2СH3COOH + 2Na → 2CH3COOONa + H2↑
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами. Ион Li+ окрашивает пламя в кармино-красный цвет, ион Na+ – в желтый, К+ – в фиолетовый
II. Соединения щелочных металлов
1) Оксиды.
Оксиды щелочных металлов типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
3Na2O + P2O5 = 2Na3PO4
Na2O + Al2O3 = 2NaAlO2
Na2O + 2HCl = 2NaCl + H2O
Na2O + 2H+ = 2Na+ + H2O
Na2O + H2O = 2NaOH
2) Пероксиды.
2Na2O2 + CO2 = 2Na2CO3 + O2↑
Na2O2 + CO = Na2CO3
Na2O2 + SO2 = Na2SO4
2Na2O + O2 = 2Na2O2
Na2O + NO + NO2 = 2NaNO2
2Na2O2 = 2Na2O + O2↑
Na2O2 + 2H2O (хол.) = 2NaOH + H2O2
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑
Na2O2 + 2HCl = 2NaCl + H2O2
2Na2O2 + 2H2SO4 (разб.гор.) = 2Na2SO4 + 2H2O + O2↑
2Na2O2 + S = Na2SO3 + Na2O
5Na2O2 + 8H2SO4 + 2KMnO4 = 5O2 + 2MnSO4 + 8H2O + 5Na2SO4 + K2SO4
Na2O2 + 2H2SO4 + 2NaI = I2 + 2Na2SO4 + 2H2O
Na2O2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + Na2SO4 + 2H2O
3Na2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8NaOH + 2H2O
3) Основания (щелочи).
2NaOH(избыток) + CO2 = Na2CO3 + H2O
NaOH + CO2 (избыток) = NaHCO3
SO2 + 2NaOH (избыток) = Na2SO3 + H2O
SiO2 + 2NaOH 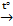 Na2SiO3 + H2O
Na2SiO3 + H2O
2NaOH + Al2O3  2NaAlO2 + H2O
2NaAlO2 + H2O
2NaOH + Al2O3 + 3H2O = 2Na[Al(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4]
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO3 = K2CO3 + H2O
2NaOH + Si + H2O = Na2SiO3 + H2
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
4) Соли.
2NaNO3  2NaNO2 + O2
2NaNO2 + O2
Na2CO3 + 2NH4Cl = 2NaCl + CO2 + 2NH3 + Н2О
NaHCO3 + HNO3 = NaNO3 + CO2 + H2O
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
NaI → Na+ + I–
на катоде: 2Н2О + 2e → H2 + 2OH– 1
на аноде: 2I– – 2e → I2 1
2Н2О + 2I–  H2 + 2OH– + I2
H2 + 2OH– + I2
2H2O + 2NaI  H2 + 2NaOH + I2
H2 + 2NaOH + I2
8KI + 5H2SO4(конц.) = 4K2SO4 + H2S + 4I2 + 4H2O
2NaCl  2Na + Cl2
2Na + Cl2
на катоде на аноде
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
2Na2HPO4  Na4P2O7 + H2O
Na4P2O7 + H2O
KNO3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
4KClO3  KCl + 3KClO4
KCl + 3KClO4
2KClO3  2KCl + 3O2
2KCl + 3O2
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
Na2SO3 + S = Na2S2O3
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O
2NaI + Br2 = 2NaBr + I2
2NaBr + Cl2 = 2NaCl + Br2
I A группа.
1. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезает через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
2. Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
3) Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганата калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким запахом. Напишите уравнения описанных реакций.
4) Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, внесли в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой, и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций
5) Вещество, полученное на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Поученный продукт последовательно обработали сернистым газом и раствором гидроксида бария. Напишите уравнения описанных реакций
6) Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода; при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций
7) Неизвестный металл сожгли в кислороде. Продукт реакции, взаимодействует с углекислым газом, образует два вещества: твердое, которое взаимодействует с раствором соляной кислоты с выделением углекислого газа, и газообразное простое вещество, поддерживающее горение. Напишите уравнения описанных реакций.
8) Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели, выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
9) При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха; при нагревании этой соли без катализатора образуются соль Б и соль высшей кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется желто-зеленый газ (простое вещество) и образуется соль Б. Соль Б окрашивает пламя в фиолетовый цвет, при ее взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
10) К нагретой концентрированной серной кислотой добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагрели с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
11) Поваренную соль обработали концентрированной серной кислотой. Полученную соль обработали гидроксидом натрия. Полученный продукт прокалили с избытком угля. Выделившийся при этом газ прореагировал в присутствии катализатора с хлором. Напишите уравнения описанных реакций.
12) Натрий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с хлором, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
13) Натрий сожгли в избытке кислорода, полученное кристаллическое вещество поместили в стеклянную трубку и пропустили через неё углекислый газ. Газ, выходящий из трубки, собрали и сожгли в его атмосфере фосфор. Полученное вещество нейтрализовали избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
14) К раствору, полученному в результате взаимодействия пероксида натрия с водой при нагревании, добавили раствор соляной кислоты до окончания реакции. Раствор образовавшейся соли подвергли электролизу с инертными электродами. Газ, образовавшийся в результате электролиза на аноде, пропустили через суспензию гидроксида кальция. Напишите уравнения описанных реакций.
15) Через раствор гидроксида натрия пропустили сернистый газ до образования средней соли. К полученному раствору прилили водный раствор перманганата калия. Образовавшийся осадок отделили и подействовали на него соляной кислотой. Выделившийся газ пропустили через холодный раствор гидроксида калия. Напишите уравнения описанных реакций.
16) Смесь оксида кремния (IV) и металлического магния прокалили. Полученное в результате реакции простое вещество обработали концентрированным раствором гидроксида натрия. Выделившийся газ пропустили над нагретым натрием. Образовавшееся вещество поместили в воду. Напишите уравнения описанных реакций.
17) Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали раствором хлорида бария. Раствор профильтровали, а фильтрат смешали с раствором нитрата натрия и нагрели. Напишите уравнения описанных реакций.
18) Натрий нагрели в атмосфере водорода. При добавлении к полученному веществу воды наблюдали выделение газа и образование прозрачного раствора. Через этот раствор пропустили бурый газ, который был получен в результате взаимодействия меди с концентрированным раствором азотной кислоты. Напишите уравнения описанных реакций.
19) Гидрокарбонат натрия прокалили. Полученную соль растворили в воде и смешали с раствором алюминия, в результате образовался осадок и выделился бесцветный газ. Осадок обработали избытком раствора азотной кислоты, а газ пропустили через раствор силиката калия. Напишите уравнения описанных реакций.
20) Натрий сплавили с серой. Образовавшееся соединение обработали соляной кислотой, выделившийся газ нацело прореагировал с оксидом серы (IV). Образовавшееся вещество обработали концентрированной азотной кислотой. Напишите уравнения описанных реакций.
21) Натрий сожгли в избытке кислорода. Образовавшееся вещество обработали водой. Полученную смесь прокипятили, после чего в горячий раствор добавили хлор. Напишите уравнения описанных реакций.
22) Калий нагрели в атмосфере азота. Полученное вещество обработали избытком соляной кислоты, после чего к образовавшейся смеси солей добавили суспензию гидроксида кальция и нагрели. Полученный газ пропустили рад раскаленным оксидом меди (II).Напишите уравнения описанных реакций.
23) Калий сожгли в атмосфере хлора, образовавшуюся соль обработали избытком водного раствора нитрата серебра. Выпавший осадок отфильтровали, фильтрат выпарили т осторожно нагрели. Образовавшуюся соль обработали водным раствором брома. Напишите уравнения описанных реакций.
24) Литий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с бромом, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
25) Натрий сожгли на воздухе. Образовавшееся при этом твердое вещество поглощает углекислый газ с выделением кислорода и соли. Последнюю соль растворили в соляной кислоте, а к полученному при этом раствору добавили раствор нитрата серебра. При этом выпал белый осадок. Напишите уравнения описанных реакций.
26) Кислород подвергли воздействию электроразряда в озонаторе. Полученный газ пропустили через водный раствор йодида калия, при этом выделился новый газ без цвета и запаха, поддерживающий горение и дыхание. В атмосфере последнего газа сожгли натрий, а полученное при этом твердое вещество прореагировало с углекислым газом. Напишите уравнения описанных реакций.
I A группа.
1. N2 + O2  2NO
2NO
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3  2NaNO2 + O2
2NaNO2 + O2
2. 2NaCl  2Na + Cl2
2Na + Cl2
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2CO3 + 2NH4Cl = 2NaCl + CO2 + 2NH3 + Н2О
3. NaHCO3 + HNO3 = NaNO3 + CO2 + H2O
2NaNO3  2NaNO2 + O2
2NaNO2 + O2
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
4. 2H2O + 2NaI  H2 + 2NaOH + I2
H2 + 2NaOH + I2
2K + I2 = 2KI
8KI + 5H2SO4(конц.) = 4K2SO4 + H2S + 4I2 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3↓ + 3S↓ + 4KOH
5. 2NaCl  2Na + Cl2
2Na + Cl2
на катоде на аноде
2Na + O2 = Na2O2
Na2O2 + SO2 = Na2SO4
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
6. P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2Na2HPO4  Na4P2O7 + H2O
Na4P2O7 + H2O
7. 2Na + O2  Na2O2
Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
C + O2 = CO2
8. 2KOH + 2NO2 + O2 = 2KNO3 + H2O
KNO3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
NH3 + HNO3 = NH4NO3
NH4NO3  N2O + 2H2O (190 – 245°C)
N2O + 2H2O (190 – 245°C)
2NH4NO3  2NO + N2 + 4H2O (250 – 300°C)
2NO + N2 + 4H2O (250 – 300°C)
2NH4NO3  2N2 + О2 + 4H2O (выше 300°C)
2N2 + О2 + 4H2O (выше 300°C)
9. 2KClO3  2KCl + 3O2 ↑
2KCl + 3O2 ↑
4KClO3  KCl + 3KClO4
KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
10. 2H2SO4(конц.) + Cu = CuSO4 + SO2 ↑ + 2H2O
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + S = Na2S2O3
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O
11. NaCl(тверд.) + H2SO4(конц.) = NaHSO4 + HCl↑
NaHSO4 + NaOH = Na2SO4 + H2O
Na2SO4 + 4C  Na2S + 4CO↑
Na2S + 4CO↑
CO + Cl2  COCl2
COCl2
12) 2Na + H2 = 2NaH
NaH + H2O = NaOH + H2↑
H2 + Cl2 = 2HCl
6NaOH + 3Cl2 = NaClO3 + 5NaCl + 3H2O
13) 2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
4P + 5O2 = 2P2O5
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
14) 2Na2O2 + 2H2O = 4NaOH + O2↑
NaOH + HCl = NaCl + H2O
2H2O + 2NaCl  H2↑ + 2NaOH + Cl2↑
H2↑ + 2NaOH + Cl2↑
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
15) 2NaOH + SO2 = Na2SO3 + H2O
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
2NaOH(холодный) + Cl2 = NaCl + NaClO + H2O
16) SiO2 + 2Mg = 2MgO + Si
2NaOH + Si + H2O = Na2SiO3 + 2H2
2Na + H2 = 2NaH
NaH + H2O = NaOH + H2
17) 6Li + N2 = 2Li3N
Li3N + 3H2O = 3LiOH + NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
18) 2Na + H2 = 2NaH
NaH + H2O = NaOH + H2
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
2NaOH + 2NO2 = NaNO3 + NaNO2 + H2O
19) 2NaHCO3  Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
3Na2CO3 + 2AlBr3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaBr
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
К2SiO3 + 2CO2 + 2H2O = 2КHCO3 + H2SiO3↓
20) 2Na + S = Na2S
Na2S + 2HCl = 2NaCl + H2S↑
SO2 + 2H2S = 3S + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
21) 2Na + O2 = Na2O2
Na2O2 + 2H2O = 2NaOH + H2O2
2H2O2  2H2O + O2
2H2O + O2
6NaOH (гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
22) 6K + N2 = 2K3N
K3N + 4HCl = 3KCl + NH4Cl
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
2NH3 + 3CuO = N2 + 3Cu + 3H2O
23) 2K + Cl2 = 2KCl
KCl + AgNO3 = KNO3 + AgCl↓
2KNO3  2KNO2 + O2
2KNO2 + O2
KNO2 + Br2 + H2O = KNO3 + 2HBr
24) 2Li + H2 = 2LiH
LiH + H2O = LiOH + H2
H2 + Br2 = 2HBr
6LiOH(гор.) + 3Cl2 = LiClO3 + 5LiCl + 3H2O
25) 2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
26) 3O2 ↔ 2O3
O3 + 2KI + H2O = I2 + O2↑ + 2KOH
2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
IIА группа
I. Металлы IIA группы.
Химические свойства щелочноземельных металлов во многом напоминают свойства щелочных металлов, а магний и бериллий имеют некоторые характерные особенности.
Бериллий, магний и щелочноземельные металлы горят на воздухе.
2Be + O2 = 2BeO
2Mg + O2 = 2MgO
2Ba + O2 = 2BaO
2Сa + O2 = 2CaO
Взаимодействие с неметаллами приводит к образованию бинарных соединений.
Са + S = СаS
Mg + S = MgS
2Mg + Si 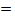 Mg2S
Mg2S
3Mg + N2 = Mg3N2
3Ba + N2 = Ba3N2
Са + H2 = CaH2
Be + S = BeS
Be + Cl2 = BeCl2
При комнатной температуре с водой реагируют только щелочноземельные металлы. Магний при нагревании.
Ca + 2H2O = Ca(OH)2 + H2↑
Mg + 2H2O  Mg(OH)2 + H2↑
Mg(OH)2 + H2↑
Металлы IIА группы активно реагируют с разбавленными кислотами:
Mg + 2HCl = MgCl2 + Н2
Mg + H2SO4(разб.) = MgSO4 + H2
Ве + 2HCl = ВеCl2 + Н2
Бериллий не только образует амфотерные оксид и гидроксид, но и сам реагирует с щелочами в концентрированных растворах или при сплавлении:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
Be + 2NaOH  Na2BeO2 + H2
Na2BeO2 + H2
Взаимодействие с кислотами окислителями (азотной, концентрированной серной)
3Ве + 8HNO3 (разб. гор.) = 3Ве(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
4Ca + 10HNO3 (разб.) = 4Ca(NO3)2 + N2O + 5H2O
4Ca + 10HNO3 (оч. разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O
4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
4Са + 5H2SO4(конц.) = 4СаSO4 + H2S + 4H2O
При взаимодействии с аммиаком образуются амиды и водород:
3Mg + 2NH3  Mg3N2 + 3H2
Mg3N2 + 3H2
Магний и кальций используют в качестве восстановителей.
MoO + Mg 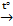 Mo + MgO
Mo + MgO
V2O5 + 5Ca 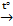 5CaO + 2V
5CaO + 2V
Магний восстанавливает из оксидов не только металлы, но и неметаллы
2Mg + CO2  2MgO + C
2MgO + C
2Mg + SiO2  Si + 2MgO (ниже 800°С)
Si + 2MgO (ниже 800°С)
4Mg + SiO2  Mg2Si + 2MgO (1000°С)
Mg2Si + 2MgO (1000°С)
2CO2 + 5Ca  CaC2 + 4CaO
CaC2 + 4CaO
4Mg + KNO3 + 6H2O = KOH + 4Mg(OH)2 + NH3
II. Cоединения металлов IIА группы
1) Оксиды.
Оксид магния, оксиды щелочноземельных металлов – основные. Вступают в реакции с водой, кислотными оксидами, кислотами. Оксид бериллия – амфотерный. Амфотерность оксида бериллия выражается в его способности реагировать как с кислотами, так и с щелочами при сплавлении или в растворе.
CaO + H2O = Ca(OH)2 (реакция идет при комнатной температуре)
MgO + H2O(пар) = Mg(OH)2 (100° – 150°С)
CaO + CO2 = CaCO3
MgO + H2SO4 = MgSO4 + H2O
MgO + 2HI = MgI2 + H2O
MgO + 2HCl = MgCl2 + H2O
MgO + 2HNO3 = Mg(NO3)2 + H2O
BaO + 2H2S = Ba(HS)2 + H2O
BeO + 2HCl = BeCl2 + H2O
BeO + 2NaOH  Na2BeO2 + H2O
Na2BeO2 + H2O
BeO + 2NaOH + H2O = Na2[Be(OH)4]
BaO2 + 2H2SO4 + 2FeSO4 = BaSO4 + Fe2(SO4)3 + 2H2O
MgO + H2O + CO2 = (MgOH)2CO3
MgO + CO = Mg + CO2
3BaO + Si = BaSiO3 + 2Ba
СaO + C 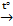 CaC2 + CO
CaC2 + CO
MgO + C = Mg + CO
2MgO + CaO + Si = CaSiO3 + 2Mg
2) Гидроксиды.
Гидроксид магния, гидроксиды щелочноземельных металлов – характер основный, гидроксид бериллия – характер амфотерный.
Сa(OH)2 (избыток) + CO2 = СaCO3 + H2O
Ca(OH)2 + 2CO2(избыток) = Ca(HCO3)2
Ca(OH)2(избыток) + SO2 = CaSO3↓ + H2O
Ca(OH)2 + 2SO2(избыток) = Ca(HSO3)2
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Ca(OH)2 + 2CH3COOH = (CH3COO)2Ca + 2H2O
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
3Mg(OH)2 + H3PO4 = (MgOH)3PO4 + 3H2O
Mg(OH)2  MgO + H2O
MgO + H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
3) Соли.
Са(НСО3)2 + 2HNO3 = Ca(NO3)2 + 2H2O + 2CO2
СаСО3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
(CH3COO)2Ca + Na2CO3 = CaCO3↓+ 2CH3COONa
Ca(NO3)2 + Na2CO3 = CaCO3↓ + 2NaNO3
Ca(ClO)2 + 4NaBr + 2H2O = CaCl2 + 4NaOH + 2Br2
CaCO3 + C  CaC2 + 3CO
CaC2 + 3CO
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
CaCO3  CaO + CO2
CaO + CO2
Са(НСО3)2  CaCO3
CaCO3  + CO2 + H2O
+ CO2 + H2O
2Ca(NO3)2  2CaO + 4NO2 + O2
2CaO + 4NO2 + O2
CaCl2  Ca + Cl2
Ca + Cl2
на катоде на аноде
CaCO3 + CO2 + H2O = Ca(HCO3)2
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2СО2
Ca3(PO4)2 + 5C + 3SiO2 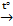 3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
CaCO3·MgCO3 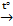 CaO + MgO + 2CO2
CaO + MgO + 2CO2
BaSO3 + H2O2 = BaSO4 + H2O
BaS + 2HCl = BaCl2 + H2S↑
BаСО3 + 2HNO3 = Ba(NO3)2 + H2O + CO2↑
BaCO3 + 2HCl = BaCl2 + CO2 ↑ + H2O
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Ba(NO3)2 + FeSO4 = Fe(NO3)2 + ↓BaSO4
Ba(HS)2 + Na2CO3 = ↓BaCO3 + 2NaHS
Ba(NO3)2 + Na2SO4 = ↓BaSO4 + 2NaNO3
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
2Ba(NO3)2  2BaO + 4NO2↑ + O2↑
2BaO + 4NO2↑ + O2↑
CH3 – C – O – Ba – O – C – CH3  BaCO3 + CH3 – C – CH3
BaCO3 + CH3 – C – CH3
║ ║ ║
O O O
BaSO4 + 4C = BaS + 4CO
BaSO4 + 3C  BaS + 2CO + СО2
BaS + 2CO + СО2
BaSO4 + 4CO = BaS + 4CO2
BaSO4 + 4H2 = BaS + 4H2O
Ba(H2PO4)2 + 2Ba(OH)2 = Ba3(PO4)2 + 4H2O
Ba3(PO4)2 + 5C  3BaO + 2P + 5CO
3BaO + 2P + 5CO
3Ba(NO3)2 + 2Na3PO4 = Ba3(PO4)2↓ + 6NaNO3
Ba3(PO4)2 + 6HNO3 = 3Ba(NO3)2 + 2H3PO4
Ba(H2PO4)2 + 2HNO3 = Ba(NO3)2 + 2H3PO4
Mg(CH3COO)2 + 2NaOH = ↓Mg(OH)2 + 2CH3COONa
MgSO4 + (CH3COO)2Ba = ↓BaSO4 + (CH3COO)2Mg
MgI2 + 2AgNO3 = ↓2AgI + Mg(NO3)2
MgSO4 + Ba(NO3)2 = ↓BaSO4 + Mg(NO3)2
MgSO4 + Na2S = MgS↓ + Na2SO4
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
2Mg(NO3)2  2MgO + 4NO2↑ + O2↑
2MgO + 4NO2↑ + O2↑
2MgSO4  2MgO + 2SO2 + O2
2MgO + 2SO2 + O2
MgCO3 + H2SO4 = MgSO4 + CO2↑ + H2O
MgS + 2HBr = MgBr2 + H2S↑
SrCO3 + CO2 + H2O = Sr(HCO3)2
SrSO4 + 4CО  SrS + 4CO2
SrS + 4CO2
Sr(HCO3)2  SrCO3 + CO2 + H2O
SrCO3 + CO2 + H2O
SrCO3 + 2HNO3 = Sr(NO3)2 + CO2↑ + H2O
Sr(NO3)2 + Na2SO3 = ↓SrCO3 + 2NaNO3
SrSO3 + H2O2 = SrSO4 + H2O
4) Бинарные соединения.
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Са3Р2 + 6Н2О = 2РН3↑ + 3 Са(ОН)2
Mg3N2 + 3H2SO4 = 3MgSO4 + 2NH3↑
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
Mg2Si + 4H2O(хол.) = 2Mg(OH)2↓ + SiH4↑
СаH2 + 2H2O = Ca(OH)2 + H2↑
Ba3N2 + 6H2O = ↓3Ba(OH)2 + 2NH3
5Ca3P2 + 16KMnO4 + 24H2SO4 = 5Ca3(PO4)2 + 16MnSO4 + 8K2SO4 + 24H2O
Ca3P2 + 2KMnO4 + 4H2O = 3Ca(OH)2 + 2MnO2 + 2KOH + 2P
Ca3P2 + 8Cl2 + 8H2O = Ca3(PO4)2 + 16HCl
Ca3P2 (тв). + 8H2SO4(конц.) = Ca3(PO4)2 + 8SO2 + 8H2O
Ca3P2 + 22HNO3 = 3Ca(NO3)2 + 16NO2 + 2H3PO4 + 8H2O
3Ca3P2 + 8K2Cr2O7 + 64HCl = 3Ca3(PO4)2 + 16KCl + 16CrCl3 + 32H2O
Ca(ClO)2 + 4NaBr + 2H2O = CaCl2 + 4NaOH + 2Br2
IIА группа
1. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась, и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета; осадок растворился при дальнейшем пропускании газа. При кипячении полученного раствора выпадает осадок. Напишите уравнения описанных реакций.
2. Кальций растворили в воде. При пропускании через полученный раствор сернистого газа образуется осадок белого цвета, который растворяется при пропускании избытка газа. Добавление к полученному раствору щелочи приводит к образованию осадка белого цвета. Напишите уравнения описанных реакций.
3. Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и пркалили. При обработке продукта прокаливания хлороводородной кислотой выделился газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
4. Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
5. Через баритовую воду пропускали углекислый газ. В полученный раствор добавили гидроксид бария, продукт реакции отделили и растворили в ортофосфорной кислоте.
Напишите уравнения описанных реакций.
6. Через раствор, полученный при гашении извести, пропустили газ, который образуется при получении негашеной извести из известняка; в результате выделяется белый осадок. При действии уксусной кислоты на полученный осадок выделяется тот же газ, который образуется при прокаливании карбоната кальция. Напишите уравнения описанных реакций.
7. Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при кальцинировании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение осадка. Напишите уравнения описанных реакций.
8. Вещество, образующееся при сплавлении магния с кремнием, обработали водой, в результате образовался осадок и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
9. Магниевую стружку нагрели в атмосфере азота и продукт реакции последовательно обработали кипящей водой, растворами серной кислоты и нитрата бария. Напишите уравнения описанных реакций
10. Негашеную известь прокалили с избытком кокса. Продукт реакции после обработки водой используется для поглощения сернистого и углекислого газов. Напишите уравнения описанных реакций.
11. Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагрели до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.
12. Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
13. Простое вещество, полученное при нагревании фосфата кальция с коксом и оксидом кремния, сплавили с металлическим кальцием. Продукт реакции обработали водой, а выделяющийся газ собрали и пропустили через раствор соляной кислоты. Напишите уравнения описанных реакций.
14. Фосфат кальция прокалили с углём в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
15) Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода.
Напишите уравнения описанных реакций.
16) Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
17) Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
18) Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. выделившийся при этом газ прореагировал с избытком гидроксида кальция с выпадением осадка белого цвета. Осадок растворили в избытке раствора бромоводородной кислоты и в полученный раствор добавили раствор нитрата серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций.
19) Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций.
20) Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твердый продукт сжигания растворили в концентрированном растворе гидроксида цезия. Напишите уравнения описанных реакций.
21) Магний нагрели в атмосфере азота. При добавлении к полученному веществу воды выделился газ, который пропустили над нагретым оксидом свинца (II). Полученное твердое вещество темного цвета растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
22) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ сначала пропустили над нагретым оксидом меди (II), а полученный газ пропустили через раствор гидроксида кальция до тех пор, пока первоначально выпавший осадок не растворился. Напишите уравнения описанных реакций.
23) Барий растворили в воде. К полученному раствору добавили сульфат калия, выпавший осадок отфильтровали, после чего через горячий фильтрат пропустили газообразный хлор. Реакционную массу выпарили, а затем прокалили до образования одной соли. Напишите уравнения описанных реакций.
24) Магний растворили в разбавленной азотной кислоте. К полученному раствору последовательно добавили гидроксид натрия, бромоводородную кислоту, фосфат натрия. Напишите уравнения описанных реакций.
25) Барий растворили в разбавленной азотной кислоте, при этом выделился бесцветный газ – несолеобразующий оксид. Полученный раствор разделили на три части. Первую выпармлм досуха, полученный осадок прокалили. Ко второй части добавили раствор сульфата натрия до прекращения выделения осадка; к третьей добавили раствор карбоната натрия. Напишите уравнения описанных реакций.
26) Сульфат бария сплавили с коксом. Твердый остаток растворили в соляной кислоте, выделившийся газ вступил в реакцию оксидом серы (IV), а раствор – с сульфитом натрия. Напишите уравнения описанных реакций.
IIА группа
1) СаСО3 + 2HCl = CaCl2 + CO2↑ + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
Ca(HCO3)2  CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O
2) Ca + 2H2O = Ca(OH)2 + H2↑
Ca(OH)2 + SO2 = CaSO3↓ + H2O
CaSO3 + SO2 + H2O = Ca(HSO3)2
Ca(HSO3)2 + Ca(OH)2 = 2CaSO3↓ + 2H2O
3) SO2 + Br2 + 2H2O = 2HBr + H2SO4
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
BaSO4 + 4С  BaS + 4CO↑
BaS + 4CO↑
BaS + 2HCl = ВaCl2 + H2S↑
4) Са + H2 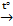 CaH2
CaH2
СаH2 + 2H2O = Ca(OH)2 + H2↑
ZnO + H2 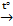 Zn + H2O
Zn + H2O
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
5) Ba(OH)2 + CO2 = BaCO3 + H2O
BaСО3 + CO2 + H2O = Вa(HCO3)2
Вa(HCO3)2 + Ba(OH)2 = 2BaCO3↓ + 2H2O
BaCO3 + 2Н3РО4 = СО2 + H2O + Ва(Н2РО4)2
6) СаСО3  СаО + СО2↑
СаО + СО2↑
СаО + Н2О = Са(ОН)2
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2СН3СООН = (СН3СОО)2Са + СО2 ↑ + H2O
7) CaO + H2O = Ca(OH)2
2NaHCO3 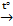 Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
8) 2Mg + Si 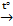 Mg2Si
Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
3SiH4 + 8KMnO4 = 8MnO2 ↓ + 3SiO2 ↓ + 8KOH + 2H2O
9) 3Mg + N2 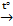 Mg3N2
Mg3N2
Mg3N2 + 6H2O(гор.) = 3Mg(OH)2↓ + 2NH3↑
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
MgSO4 + Ba(NO3)2 = BaSO4↓ + Mg(NO3)2
10) СaO + C 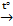 CaC2 + CO↑
CaC2 + CO↑
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Ca(OH)2 + CO2 = CaCO3↓ + H2O
или Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ca(OH)2 + SO2 = CaSO3↓ + H2O
или Ca(OH)2 + 2SO2 = Ca(HSO3)2
11) 3Mg + 2NH3 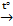 Mg3N2 + 3H2↑
Mg3N2 + 3H2↑
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
NH4Br 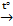 NH3↑ + HBr↑
NH3↑ + HBr↑
MgBr2 + 2NaOH = Mg(OH)2↓ + 2NaBr
12) 2Mg + Si 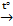 Mg2Si
Mg2Si
Mg2Si + 4H2O(хол.) = 2Mg(OH)2↓ + SiH4↑
SiH4+ 2H2O(гор.) = SiO2 + 4Н2
SiO2 + 2NaOH  Na2SiO3 + H2O
Na2SiO3 + H2O
13) Ca3(PO4)2 + 5C + 3SiO2 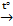 3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
3Ca + 2P 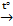 Ca3P2
Ca3P2
Ca3P2 + 6H2O = 3Ca(OH)2↓ + 2PH3↑
PH3 + HCl = PH4Cl
14) Ca3(PO4)2 + 5C + 3SiO2 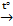 3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
2K3PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6KOH
15) 3Ca + N2 = Ca3N2
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
3NH3 + 3H2O + Cr(NO3)3 = Cr(OH)3↓ + 3NH4NO3
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
16) KNO2 + NH4Cl  KCl + N2↑ + 2H2O
KCl + N2↑ + 2H2O
3Mg + N2 = Mg3N2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3↓ + CO2↑ + 4NaCl
17) 4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3
NH4NO3 + KOH  NH3↑ + KNO3 + H2O
NH3↑ + KNO3 + H2O
4NH3 + 3O2 = 2N2 + 6H2O
18) 3NaNO3 + Cr2O3 + 2Na2CO3 = 2Na2CrO4 + 2CO2↑ + 3NaNO2
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CaCO3 + 2HBr = CaBr2 + CO2↑ + H2O
CaBr2 + 2AgNO3 = 2AgBr↓ + Ca(NO3)2
19) Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
PH3 + 2O2 = H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO3
20) SiO2 + 2Mg = 2MgO + Si
2Mg + Si = Mg2Si или
SiO2 + 4Mg = 2MgO + Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + 2CsOH = Cs2SiO3 + H2O
21) 3Mg + N2 = Mg3N2
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
2NH3 + 3PbO = 3Pb + N2 + 3H2O
3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O
22) H2C2O4  H2O + CO↑ + CO2↑
H2O + CO↑ + CO2↑
CO + CuO = Cu + CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
23) Ba + 2HCl = BaCl2 + H2
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
BaSO4 + 4C  BaS + 4CO
BaS + 4CO
3CO + Fe2O3  2Fe + 3CO2
2Fe + 3CO2
24) 4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O + 5H2O
Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
3MgBr2 + 2Na3
 2020-06-29
2020-06-29 111
111







