Определение осахаривающей активности йодометрическим методом
Осахаривающая активность характеризует способность солода или ФП микробного происхождения гидролизовать крахмал до редуцирующих сахаров: мальтозы, глюкозы или их смеси. Мальтоза является конечным продуктом гидролиза крахмала растительными a- и b-амилазами. Таким образом, осахаривающая активность отражает действие одного или нескольких ферментов на данный субстрат. Осахаривающую активность ОАК (в литературе чаще принято называть ее ОС) выражают числом единиц, содержащихся в 1 г, 1 см3 осахаривающего материала.
Осахаривающую активность определяют тремя методами: йодометрическим, колориметрическим с использованием антрона и поляриметрическим.
Осахаривающая активность определяется в условиях гидролиза растворимого крахмала в пределах 25% гликозидных связей, что соответствует гидролизу примерно 50% крахмала до мальтозы или мальтозы в смеси с глюкозой. За единицу ОАК принимают такое количество фермента, которое в строго определенных условиях за 1 мин при температуре 300С катализирует расщепление до восстанавливающих сахаров 1 микроэквивалент гликозидных связей.
|
|
|
Определение осахаривающей активности амилосубтилина Г10х
Анализу подвергают препарат, полученный при выращивании продуцента глубинным способом.
Реактивы и аппаратура: 0,1 моль/дм3 раствор йода (25 г КJ ч.д.а. растворяют в 2 – 3 см3 воды и добавляют 12,5 г х.ч. йода. После растворения йода объем раствора доводят до 1 дм3 дистиллированной водой. Раствор хранят в темной склянке с притертой пробкой. Титр устанавливают по 0,1моль/дм3 раствору тиосульфата натрия. Концентрация раствора йода должна быть в пределах 0,95 – 1,05 моль/дм3); 0,1 моль/дм3 раствор тиосульфата натрия (25 г тиосульфата ч.д.а. растворяют в 1 дм3 дистиллированной воды, не содержащей СО2); 1 моль/дм3 раствор НС1; 0,1моль/дм3 раствор гидроксида натрия; раствор серной кислоты 1: 4 (к четырем объемам дистиллированной воды приливают один объем кислоты); фосфатный буферный раствор с рН 6,0 готовят смешиванием 9 объемов раствора I (9,077 г КН2РО4 растворяют в 1 дм3 воды) и одного раствора 2 (23,883 г К2НРО4 × 2Н2О растворяют в 1 дм3 воды); 1%-й раствор крахмала.
Ход определения. Вначале готовят 1%-й раствор крахмала, как при определении амилолитической активности солода, но вместо фосфатного буфера с рН 4,7 – 4,9 используют 10 см3 фосфатного буферного раствора с рН6,0.
Для приготовления раствора ФП взвешивают 0,1 г препарата в сухом стакане вместимостью 25–30 см3. Навеску осторожно растирают стеклянной палочкой с небольшим количеством воды. Полученную смесь быстро и без потерь переносят дистиллированной водой в колбу на 100 см3. После доведения до метки смесь перемешивают и фильтруют через складчатый фильтр. Раствор хранят не более 24 ч при температуре от +2 до –40С. Далее осахаривают крахмал и определяют сахар йодометрически. Схема рабочего и контрольного опытов, которые проводят одновременно, приведена ниже.
|
|
|
Расхождение между результатами титрования контрольного Б и опытного А растворов должно составлять 0,5 – 6 см3 0,1 моль/дм3 раствора тиосульфата натрия. Если расхождение меньше 0,5 или больше 6 см3, анализ повторяют с большим или меньшим количеством ферментного раствора.
Осахаривающую активность ОАК (в ед/г) рассчитывают по формуле
ОАК = е1: (m ×τ),
где е1 – количество единиц активности в микроэквивалентах гликозидных связей, найденных по табл. 4, в соответствии с результатами титрования;
m – количество ФП, введенного в реакционную смесь, г;
τ – время гидролиза, мин.
Пример. Определить осахаривающую активность амилосубтилина Г10х, если на анализ израсходовано 0,1 г исходного ФП.
На титрование контрольного раствора пошло 19,6 см3 (Б), а рабочего – 17,6 см3 (А) 0,1 моль/дм3 раствора Na2S2O3, следовательно, Б – А = 19,6 – 17,6 = 2 см3. По таблице 4 величине 2 см3 соответствует число единиц активности е1 = 113,1. Время гидролиза – 10 мин; m = (0,1: 100) × 1 = 0,001 г. Тогда ОАК = 113,1: (0,001 × 10) = = 11310 ед/г.
| Рабочий опыт (А) | Контрольный опыт (Б) | ||||||||
| 1%-й раствор крахмала (20 см3) | 1%-й раствор крахмала (20 см3) | ||||||||

| 
| ||||||||
| Инкубирование субстрата в конической колбе на 50 см3 (t = 30 ± 0,20С, τ = 10 мин) | 1 моль/дм3 р-р НС1
 2 см3
2 см3
| Смешивание субстрата с соляной кислотой | |||||||
20 см3 
| 22 см3 
| ||||||||
Р-р ФП
 1-10 см3
Вода 1-10 см3
Вода
9-0 см3 | Ферментативный гидролиз крахмала до сахаров (t = 30 ± 0,20С, τ = 10 мин) | Р-р ФП
 1-10 см3
Вода 1-10 см3
Вода
9-0 см3 |  Смешивание подкисленного субстрата с р-ром ферментов (инактивация ферментов) Смешивание подкисленного субстрата с р-ром ферментов (инактивация ферментов)
| ||||||
 30 см3 30 см3
| 32 см3 | ||||||||
1 моль/дм3 р-р НС1
2 см3 |  Кислотная инактивация ферментов Кислотная инактивация ферментов
| ||||||||
| 32 см3 | |||||||||
0,1 моль/дм3 р-р J2
 20 см3
0,1 моль/дм3 р-р NаОН
20 см3
0,1 моль/дм3 р-р NаОН
 52,5 см3
52,5 см3
|  Йодометрическое окисление сахаров прогидролизованного субстрата в щелочной среде (t = 20 0С, τ = 15 мин; колба коническая на 300-400 см3, закрытая часовым стеклом) Йодометрическое окисление сахаров прогидролизованного субстрата в щелочной среде (t = 20 0С, τ = 15 мин; колба коническая на 300-400 см3, закрытая часовым стеклом)
| 0,1 моль/дм3 р-р J2
 20 см3
0,1 моль/дм3 р-р NаОН
20 см3
0,1 моль/дм3 р-р NаОН
 52,5 см3
52,5 см3
|  Йодометрическое окисление сахаров исходного субстрата и ФП (t = 20 0С, τ = 15 мин; колба коническая на 300-400 см3, закрытая часовым стеклом) Йодометрическое окисление сахаров исходного субстрата и ФП (t = 20 0С, τ = 15 мин; колба коническая на 300-400 см3, закрытая часовым стеклом)
| ||||||
| 104,5 см3 | 104,5 см3 | ||||||||
Р-р
Н2SО4: Н2О = 1: 4
2 см3 | Нейтрализация и подкисление среды | Р-р
Н2SО4:Н2О=1:4
2 см3 | Нейтрализация и подкисление среды | ||||||
 106,5 см3 106,5 см3
|  106,5 см3 106,5 см3
| ||||||||
0,1 моль/дм3р-р Na2S2O3

|  Определение избытка йода в рабочем опыте Определение избытка йода в рабочем опыте
|  0,1 моль/дм3р-р Na2S2O3 0,1 моль/дм3р-р Na2S2O3
|  Определение избытка йода в рабочем опыте Определение избытка йода в рабочем опыте
| ||||||
Расчет величины А Расчет величины Б
Рисунок 1 – Схема определения осахаривающей активности ферментного препарата
Таблица 4 – Количество микроэквивалентов гликозидных связей (е1) в зависимости от расхода 0,1 моль/дм3 раствора Na2S2O3
| Количество 0,1 моль/дм3 раствора Na2S2O3, см3 | Количество микроэквивалентов гликозидных связей, е1 | Количество 0,1 моль/дм3 раствора Na2S2O3, см3 | Количество микроэквивалентов гликозидных связей, е1 |
| 0,9 | 45,0 | 2,6 | 169,7 |
| 1,0 | 52,1 | 2,7 | 180,9 |
| 1,1 | 58,7 | 2,8 | 192,3 |
| 1,2 | 63,3 | 2,9 | 209,9 |
| 1,3 | 67,8 | 3,0 | 226,1 |
| 1,4 | 74,7 | 3,1 | 250,6 |
| 1,4 | 81,4 | 3,2 | 278,2 |
| 1,6 | 85,9 | 3,3 | 312,1 |
| 1,7 | 92,7 | 3,4 | 366,2 |
| 1,8 | 99,6 | 3,5 | 452,3 |
| 1,9 | 108,5 | 3,6 | 517,9 |
| 2,0 | 113,1 | 3,7 | 585,7 |
| 2,1 | 119,9 | 3,8 | 662,7 |
| 2,2 | 128,8 | 3,9 | 740,3 |
| 2,3 | 138,0 | 4,0 | 811,9 |
| 2,4 | 150,3 | 4,1 | 891,6 |
| 2,5 | 158,3 | 4,2 | 968,1 |
Определение протеолитической способности методом Лейлян‑Фольгарда
Протеолитическая способность (ПС) характеризует способность протеолитических ферментов расщеплять белок (казеин). За единицу протеолитической способности принято такое количество фермента, которое за 1 час при температуре 300С расщепляет 1 г казеина. Протеолитическую способность выражают числом указанных единиц в 1 г сухого препарата. При таком способе выражения ПС непосредственно показывает, сколько граммов казеина может быть прогидролизовано 1 г культуры при температуре 300С за 1 ч (в условиях, соответствующих условиям определения).
|
|
|
Для определения ПС растворенный при помощи гидроксида натрия казеин подвергают действию исследуемого ферментного препарата. После ферментативного воздействия в течение часа в опыте и перед добавлением такого же количества ферментного раствора в контроле ферментативную активность прерывают титрованным раствором соляной кислоты. Казеин, оставшийся нерасщепленным, количественно осаждают сульфатом натрия. Выпадая в осадок, казеин увлекает в связанном состоянии соответствующее количество соляной кислоты. Осадки отфильтровывют, а фильтраты титруют 0,1 моль/дм3 раствором NаОН. Разность между расходом 0,1 моль/дм3 раствора NаОН на титрование в опыте и в контроле принимают за меру протеолитической активности исследуемой культуры.
Реактивы: 5%-й щелочной раствор казеина – 50 г (по сухому веществу) технически измельченного казеина помещают в химический стакан емкостью 1 дм3, добавляют 50 см3 дистиллированной воды и оставляют на 30 мин. Затем помещают стакан в водяную баню температурой 65–700С. Постепенно при тщательном перемешивании стеклянной палочкой прибавляют 50 см3 1 моль/дм3 раствора NаОН. В процессе растворения казеина прибавляют небольшими порциями воду (5–6 раз по 50–80 см3), нагретую до температуры 65–700С, и выдерживают на водяной бане до полного исчезновения комочков. После полного растворения казеина и охлаждения раствор переливают в мерную колбу на 1 дм3, доводят объем до метки водой, перемешивают и фильтруют через четыре слоя марли; 0,1 моль/дм3 раствор НС1 в 7,5%-ом растворе сульфата натрия - Na2SO4; 1 моль/дм3 раствор NаОН; 0,1 моль/дм3 раствор NаОН; раствор крезолового красного – 0,5 г крезолового красного растворяют в 100 см3 96%-го ректификованного спирта и фильтруют.
|
|
|
Ход определения. Ферментный раствор приготавливают так: на технических весах взвешивают 1,00 г тщательно измельченной культуры, переводят в колбу на 200–300 см3, приливают 50 или 100 см3 дистиллированной воды и настаивают в течение часа при комнатной температуре, периодически перемешивая через каждые 10 мин, затем фильтруют через складчатый фильтр.
В колбы емкостью около 100 см3 (два параллельных определения) набирают пипеткой по 20 см3 раствора казеина и помещают в водяную баню температурой 30±0,20С. Через 10 мин в колбы вводят при помешивании 10 см3 ферментного раствора. Общий объем раствора казеина и ферментного раствора должен быть равен 30 см3; если для определения берут меньше 10 см3 ферментного раствора, недостающий до 30 см3 объем восполняют дистиллированной водой, которую вводят непосредственно перед введением ферментного раствора.
Ровно через час в колбы добавляют при перемешивании 20 см3 0,1 моль/дм3 раствор НС1 в 7,5%-ом растворе Na2SO4 и немедленно фильтруют до полной прозрачности, возвращая фильтрат на фильтр.
Контрольные пробы (также два параллельных определения) ставят таким же образом, только до введения ферментного раствора прибавляют раствор НС1 в 7,5%-ом растворе Na2SO4 и не выдерживают колбы на водяной бане, а сразу фильтруют.
В 20 см3 фильтрата контрольных и опытных определений оттитровывают избыток соляной кислоты 0,1 моль/дм3 раствором NaOH в присутствии двух капель крезолового красного до красного окрашивания. Разность в расходе на титрование опытных и контрольных проб 0,1 моль/дм3 раствора NaOH, отнесенная к 10 см3 фильтрата, может составить 0,4–2,5 см3. Если она менее 0,4 или более 2,5 см3, определение повторяют с большей или меньшей дозировкой фермента, изменяя количество вводимого ферментного раствора или его разведение. По разности расхода щелочи на титрование опытной и контрольной проб, пользуясь таблицей 5, находят протеолитическую способность культуры при условии, что для определения взято 10 см3 ферментного раствора в разведении 1: 100. При других дозировках культуры величину ПС рассчитывают по формуле
ПС = е / n,
где е – число единиц, найденное по таблице (по результатам титрования);
n – количество культуры, соответствующее 10 см3 фильтрата (1/5 от количества,
прибавленного в колбу), г или см3.
Пересчет активности на сухое вещество ведут по формуле
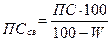 ,
,
где W – влажность культуры, %.
Пример. Для определения взято 10 см3 ферментного раствора в разведении 1: 100. На титрование опытной пробы израсходовано 4,8 см3 0,1моль/дм3 раствора NaOH; на титрование контрольной пробы – 2,0 см3. Разность в пересчете на 10 см3 фильтрата (4,8 – 2,0): 2 = 1,4 см3 0,1 моль/дм3 раствора NaOH. По таблице величина 1,4 соответствует ПС = 4,950.
Влажность культуры 12%.
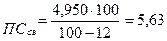 ед.
ед.
Таблица 5 – Пересчет (см3) 0,1 моль/дм3 раствора NaOH в протеолитическую способность на воздушно-сухое вещество
| Разность между расх. 0,1 моль/дм3 р-ра NaOH в опыте и контроле, см3 / 10 см3 фильтрата | Едини-цы протео-лити-ческой актив-ности | ПС при введении 10 см3 раствора в разведении | Разность между расх. 0,1 моль/дм3 р-ра NaOH в опыте и контроле, см3 / 10 см3 фильтрата | Едини-цы протео-лити-ческой актив-ности | ПС при введении 10 см3 раствора в разведении | ||
| 1: 100 | 1:50 | 1:100 | 1:50 | ||||
| 0,30 | 0,0123 | 0,615 | 0,308 | 1,45 | 0,1033 | 5,165 | 2,582 |
| 0,35 | 0,0167 | 0,835 | 0,418 | 1,50 | 0,1080 | 5,400 | 2,700 |
| 0,40 | 0,0203 | 1,015 | 0,508 | 1,55 | 0,1123 | 5,616 | 2,808 |
| 0,45 | 0,0243 | 1,215 | 0,608 | 1,60 | 0,1167 | 5,835 | 2,918 |
| 0,50 | 0,0283 | 1,415 | 0,708 | 1,65 | 0,1213 | 6,065 | 3,032 |
| 0,55 | 0,0320 | 1,600 | 0,800 | 1,70 | 0,1260 | 6,300 | 3,150 |
| 0,60 | 0,0360 | 1,800 | 0,900 | 1,75 | 0,1307 | 6,535 | 3,268 |
| 0,65 | 0,0393 | 1,965 | 0,982 | 1,80 | 0,1353 | 6,765 | 3,382 |
| 0,70 | 0,0433 | 2,165 | 1,082 | 1,85 | 0,1400 | 7,000 | 3,500 |
| 0,75 | 0,0473 | 2,365 | 1,182 | 1,90 | 0,1453 | 7,265 | 3,632 |
| 0,80 | 0,0513 | 2,565 | 1,282 | 1,95 | 0,1500 | 7,500 | 3,750 |
| 0,85 | 0, 0550 | 2,750 | 1,375 | 2,00 | 0,1556 | 7,780 | 3,890 |
| 0,90 | 0,0590 | 2,950 | 1,475 | 2,05 | 0,1603 | 8,015 | 4,008 |
| 0,95 | 0,0627 | 3,135 | 1,568 | 2,10 | 0,1653 | 8,265 | 4,132 |
| 1,00 | 0,0667 | 3,335 | 1,668 | 2,15 | 0,1707 | 8,535 | 4,268 |
| 1,05 | 0,0700 | 3,500 | 1,750 | 2,20 | 0,1760 | 8,800 | 4,400 |
| 1,10 | 0,0747 | 3,735 | 1,868 | 2,25 | 0,1817 | 9,085 | 4,542 |
| 1,15 | 0,0787 | 3,935 | 1,968 | 2,30 | 0,1873 | 9,365 | 4,682 |
| 1,20 | 0,0827 | 4,135 | 2,068 | 2,35 | 0,1933 | 9,665 | 4,832 |
| 1,25 | 0,0867 | 4,335 | 2,168 | 2,40 | 0,1993 | 9,965 | 4,982 |
| 1,30 | 0,0907 | 4,535 | 2,268 | 2,45 | 0,2053 | 10,265 | 5,182 |
| 1,35 | 0,0950 | 4,750 | 2,375 | 2,50 | 0,2113 | 10,565 | 5,282 |
| 1,40 | 0,0990 | 4,950 | 2,475 |
 2015-02-27
2015-02-27 1241
1241












