скорость газов в скруббере 3,5 м/с
гидравлическое сопротивление системы 270 мм.вод.ст.
содержание активной CaO в извести 70 %
удельное орошение газов 10 л/нм3
плотность циркулирующей суспензии 300 – 350 г/л
рН циркулирующего раствора 11 – 11,5
коэффициент использования извести 0,7
Если в качестве поглотителя использовать суспензию сульфита магния, то в качестве продукта рекуперации можно получить серную кислоту.
Лекция 13
Очистка дымовых газов от оксидов азота. Метод одновременной очистки газов от SO2 и NOx..Очистка газов от фтористых соединений. – 2 часа.
Очистка дымовых газов от оксидов азота.
Образуются при сжигании топлива в химической промышленности, при нефтеперегонке. Соединения азота: N2O, NO, N2O3, NO2, N2O4, N2O5, NO3, N2O6.
NO плохо растворим в воде, солях, органических соединениях, однако с солями Fe2+, Cu, Mn, Ni образует комплексные соединения, легко разрушающиеся при нагревании.
NO2 образуется при окислении азота кислородом, с водой легко образует азотную кислоту.
N2O3 – триоксид азота, существует только при низких температурах.
N2O4 – тетраоксид азота, образуется полимеризацией NO2 и является сильным окислителем.
N2O5 – пентаоксид азота, малоустойчив, сильный окислитель.
Основная проблема при очистке газов этим методом – низкая химическая активность и растворимость NO.
Существует несколько путей решения этой проблемы:
- окисление NO и NO2 в газовой фазе,
- частичное окисление NO в NO2 с образованием смеси NO и NO2,
- использование селективных абсорбентов,
- окисление в жидкой фазе и перевод NO в химически активное соединение.
В промышленности используется метод гомогенного окисления NO в газовой фазе кислородом. В этом процессе только 1% О2 вступает в реакцию с NO, а остальной О2 выбрасывается в атмосферу. Скорость реакции увеличивается в присутствии катализаторов (наиболее активный – гопкалит при температуре 120 0С). При окислении NOх в жидкой фазе используется О2 и О3 (озон) и зависит этот процесс от температуры, давления, концентрации компонентов, турбулентности потока.
Наилучшими окислителями являются: KBrO3, а также HNO3, KMnO4 и H2O2.
1) абсорбция водой:
3NO2 + H2O 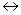 2HNO3 + NO + Q – скорость окисления мала при низких концентрациях, утилизацию NO производят пероксидом водорода Н2О2. Расход 6 кг на 4 т кислоты:
2HNO3 + NO + Q – скорость окисления мала при низких концентрациях, утилизацию NO производят пероксидом водорода Н2О2. Расход 6 кг на 4 т кислоты:
NO + H2O2 = 3NO2 + H2O = 2HNO3 + NO,
N2O3 + H2O2 = N2O4 + H2O = HNO3 + HNO2 – с получением азотной кислоты, 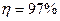
2) абсорбция щелочами (содой, раствором аммиака, NaOH):
NO2 + Na2CO3 = 2NaNO3 + CO2 + Q;
2NaOH + N2O3 = 2NaNO2 + H2O;
Na2CO3 + N2O3 = 2NaNO2 + CO2;
2NH4OH + N2O3 = 2NH4NO2 + H2O = NH4NO2 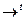 N2 + H2O.
N2 + H2O.
Селективные абсорбенты – растворы FeSO4, FeCl2, NaHCO3.
FeSO4 + NO 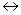 Fe(NO)SO4,
Fe(NO)SO4,
FeCl2 + NO 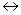 Fe(NO)Cl2, - комплексы, которые при нагреве до 95 – 100 0С распадаются, в результате NO выделяется в чистом виде, а раствор FeSO4 возвращается в производство.
Fe(NO)Cl2, - комплексы, которые при нагреве до 95 – 100 0С распадаются, в результате NO выделяется в чистом виде, а раствор FeSO4 возвращается в производство.
Процесс протекает даже при температуре 20 – 25 0С и низких концентрациях NO в газах. Присутствие в растворе H2SO4 и HNO3 и других соединений снижает поглотительную способность.
Метод одновременной очистки газов от SO2 и NOx
Образуются при сжигании сернистого топлива. Применяется комплексный метод (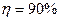 по SO2 и
по SO2 и 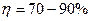 по NOx). Применяются абсорбенты: NaOH, Na2CO3, Ca(OH)2, NH4OH – в присутствии жидкофазных катализаторов, например, ЭДТК (этилендиаминтетрауксусная кислота) с добавлением соединений 2 – х валентного железа. В результате реакции оксида серы и азота превращаются в соединения, которые затем разлагаются при нагревании с образованием аммиака, азота, гипса, сульфата натрия.
по NOx). Применяются абсорбенты: NaOH, Na2CO3, Ca(OH)2, NH4OH – в присутствии жидкофазных катализаторов, например, ЭДТК (этилендиаминтетрауксусная кислота) с добавлением соединений 2 – х валентного железа. В результате реакции оксида серы и азота превращаются в соединения, которые затем разлагаются при нагревании с образованием аммиака, азота, гипса, сульфата натрия.
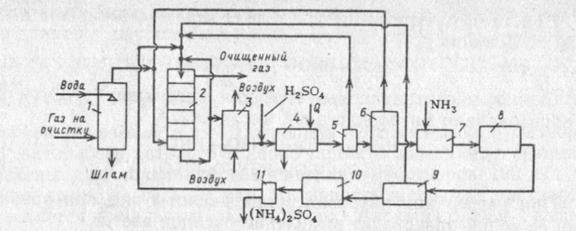 |
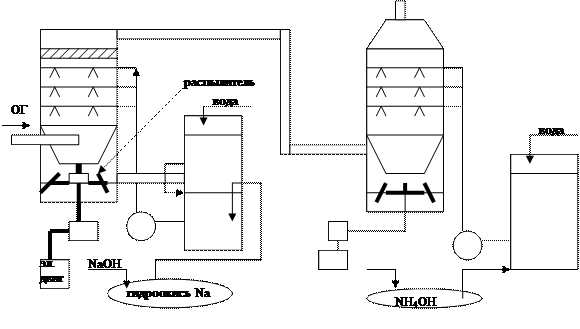
1 – пылеуловитель, 2 – тарельчатый скруббер, 3 – реактор окисления, 4 – холодильник, 5 – центрифуга, 6 – реактор, 7 – нейтрализатор, 8 – конденсатор, 9 – узел отделения железа, 10 – кристаллизатор, 11 – центрифуга.
Топочные газы сначала очищаются от пыли в скруббере, орошаемом водой (1). После этого газ подают в тарельчатый скруббер (2), орошаемый аммонизированной жидкостью с ионами Fe2+ и ЭДТК, при этом поглощается 70 – 85 % NOx и 90 % SO2. Часть жидкости после орошения отводят на окисление, барботируя раствор бисульфита аммония воздухом (3). Продукты реакции подкисляют H2SO4 и отправляют а холодильник для охдаждения до 0… - 10 0С, что позволяет кристаллизовать ЭДТК на 90 %, и отделяют от раствора в центрифуге (5) и возвращают в скруббер. Регенерационный раствор отправляют в реактор (теплообменник), где его нагревают до 120 – 130 0С и доводят до давления 0,3 Мпа и разлагают до сульфата аммония, выделяющийся раствор SO2 направляют в скруббер. А сульфат аммония нейтрализуют аммиаком, концентрируют, освобождают от соединений железе, кристаллизуют и обезвоживают.
Универсальная промышленная установка очистки газов от оксидов азота щелочными растворами с применением распылительно – вихревых аппаратов.
NO2 + Na2CO3 = NaNO3 + CO2 + O,
2NaOH + N2O3 = 2NaNO2 + H2O.
Аппарат состоит из цилиндрического корпуса, в нижней части которого расположен конус, делящий аппарат на 2 части. В нижней циклонной части установлен центробежный распылитель жидкости, приводимый во вращение электрическим двигателем. В верхней распылительной части установлены форсунки для диспергирования жидкости.
Газ на очистку поступает в нижнюю часть аппарата тангенциально. Благодаря вращению распылителя, создается развитая, постоянно обновляющаяся поверхность контакта фаз. Далее газ проходит через отверстия в конусе, где при взаимодействии газового потока с жидкостью образуется пенный слой жидкости, способствующий более полной очистке газов. При установке двух ступеней эффективность очистки составляет 99,9 %.
Очистка газов от фтористых соединений
Образуются при производстве алюминия. Объем выбрасываемых фторсодержащих газов 300 – 1000 тыс. м3/ч, газы загрязнены другими примесями, что осложняют очистку. Для очистки применяют: вода, растворы щелочей, солей: Na2CO3, NH4OH, NH4F, Ca(OH)2, NaCl, K2SO4.
2H2O + 2F = H3O+ + HF2-,
HF 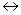 H+ + F-,
H+ + F-,
F- + HF 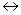 HF2-
HF2-
Фторид водорода хорошо растворим в воде, и протекают реакции гидратации и диссоциации (SiF4 – тетрафторид кремния)
SiF4 + 2H2O 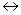 4HF + SiO2,
4HF + SiO2,
2HF + SiF4 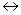 H2SiF6,
H2SiF6,
3SiF4 + 2H2O 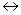 2H2SiF6 + SiO2 – образуется кремнефтористо-водородная кислота.
2H2SiF6 + SiO2 – образуется кремнефтористо-водородная кислота.
При концентрации 2H2SiF6 > 32% останавливается процесс улавливания, введение добавок в виде солей и щелочей способствует более глубокой очистке. Степень очистки 90 – 95 %.
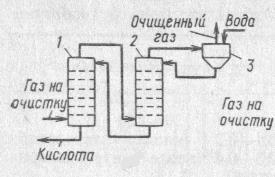 Двухступенчатая схема:
Двухступенчатая схема:
1, 2 – абсорберы,
3 – брызгоуловитель.
Отходящие газы поступают на первый абсорбер, орошаемый H2SiF6, затем газ проходит второй абсорбер и брызгоуловитель, куда подают чистую воду. Здесь происходит окончательная доочистка газов с образованием разбавленной кислоты, который направляют во 2й абсорбер. Абсорбер представляет собой колонну с провальными тарелками из стержней, свободное сечение тарелок 30 – 50 %, 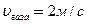 , плотность орошения 30 – 50 м3/м2 ч, концентрация полученной кислоты 25 – 30 %.
, плотность орошения 30 – 50 м3/м2 ч, концентрация полученной кислоты 25 – 30 %.
Другой метод – сжигание газов в присутствии углеводородов с получением HF, которую затем абсорбируют водой. Образующуюся H2SiF6 перерабатывают с образованием кремнефторидов. Производство криолита:
H2SiF6 + 2Al(OH)3 = AlF3 + SiO2 + H2O
криолит
Недостаток: материал аппаратов изготавливается из дерева, пластмассы, никеля.
Если в отходящих газах присутствует элементарный фтор (F), то используют 5 – 10 % раствор NaOH при t = 38 – 65 0С. Если концентрация раствора меньше 2%, а также время контакта газа со щелочью равно приблизительно 1 сек, то образуется очень ядовитое соединение (F2O), появление которого крайне нежелательно, поэтому время контакта приблизительно 1 мин, тогда:
F2 + 2NaOH = 2NaF + 1/2O2 + H2O.
Фторид натрия (NaF) плохо растворим, он способствуют образованию отложений в трубопроводах, коррозии оборудования, он токсичен, поэтому чтобы вывести его из раствора, добавляют известь:
NaF + CaO +H2O = CaF2 + 2NaOH.
Образующийся при переработке кремнефтористо-водородной кислоты (H2SiF6):
H2SiF6 + 6NH3 + 2H2O = 6NH4F + SiO2 – осаждение и отделение кремнегеля(SiO2),
NaOH + Al(OH)3 = NaAlO2 + 2H2O – получение алюмината натрия (NaAlO2),
NaAlO2 + 2NaOH + 6NH4F = Na3AlF6 + 6NH3 + 4H2O – взаимодействие NaAlO2 с фторидом алюминия и образование криолита Na3AlF6.
Очистка газов от сероводорода, сероуглерода
Сероводород содержится как примесь в природном газе и нефтяных коксохимических газах. Эти газы очень коррозионоактивны.
Для очистки применяют различные хемосорбционные методы:
| абсорбент | емкость поглотителя, моль/моль | концентрация поглотителя в р - ре | температура абсорбции, 0С | степень абсорбции, % | |
| % | г/л | ||||
| мышьяково - содовый | 1/1 | 17,4 | - | 20 – 45 | 92 – 98 |
| мышьяково - катионитовый | 3/1 | - | 16 - 18 | 35 – 50 | 94 – 99 |
| этаноламины | 1/2 | - | 10 - 15 | 20 – 50 | 96 – 98 |
| содовый | - | 15 - 18 | - | ||
| поташный | - | 20 - 25 | - | 40 – 50 | 90 – 98 |
| аммиачный | 1/1 | 5 - 15 | 20 – 30 | 85 – 90 | |
| раствор соды и сульфата никеля | - | 15 - 25 | - | 30 – 40 | 95 – 97 |
| раствор фосфата калия | 1/1 | 40 - 50 | - | 20 – 40 | 92 - 97 |
Из карбонатных абсорберов (Na2CO3, NaHCO3, K2CO3, KHCO3) лучше всех растворим поташ - K2CO3, имеющий высокую поглотительную способность, что позволяет сократить его расход, увеличив концентрацию в растворе. Но поташ очень дорогой реагент, поэтому чаще используют содовый метод.
Очистка от хлора и его соединений
Образуются при производстве хлора, щелочей методом электролиза из NaCl, получение металлического Mg, переработка цветных металлов, получение HCl, при сжигании отходов, содержащих Cl.
Для абсорбции Cl используют воду, водные растворы щелочей неорганических веществ.
2NaOH + Cl2 = NaCl + NaOCl + H2O
2Ca(OH)2 + Cl2 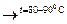 CaCl2 + Ca(OCl)2 + 2H2O
CaCl2 + Ca(OCl)2 + 2H2O
 2015-05-05
2015-05-05 1261
1261








