Международным биохимическим союзом (IUB) было принято и введено два основных принципа номенклатуры ферментов: систематическая и тривиальная. Основными принципами систематической номенклатуры ферментов являются следующие:
1. По типу катализируемых реакций все ферменты подразделяют на шесть классов, в пределах каждого из которых имеется несколько подклассов (от 4 до 13);
2. Название любого фермента состоит из 2 частей: названия субстрата и типа катализируемой реакции с окончанием «-аза». Дополнительная информация, если она необходима для уточнения особенностей функционирования фермента, заключается в скобки. Например, фермент, катализирующий реакцию:
L-малат + NAD+ → Пируват + NADH + Н+ + СО2
имеет номер 1.1.1.37 и называется L-малат: NAD+оксидоредуктаза (декарбоксилирующая).
3. Каждый фермент имеет свой шифр в соответствии с классификацией ферментов (КФ), состоящий из четырехчисел, разделенных точками. Первая цифра определяет главный класс, вторая - указывает подкласс, третья - подподкласс, четвертая - номер фермента в пределах подподкласса. Например, КФ 2.7.1.1 означает, что фермент относится к классу 2 (трансферазы), подклассу 7 (перенос фосфатных групп) и подподклассу 1 (акцептором фосфата являются спирты). Последняя цифра обозначает фермент АТР: D-гексозо-6-фосфотрансферазу, то есть фермент, катализирующий перенос фосфата с АТР на гидроксильную группу атома углерода в шестом положении гексозы.
|
|
|
Поскольку многие из этих громоздких систематических названий оказались очень длинными, каждому ферменту было присвоено тривиальное (рабочее) название, предназначенное для повседневного употребления. Рабочее название состоит из названия субстрата, на который действует данный фермент, указания на тип реакции и окончания «-аза». Например, выше рассмотренный фермент имеет тривиальное название – гексокиназа. В ряде случаев сохранились тривиальные названия, присвоенные ферментам на ранних этапах их изучения, когда название фермента состояло лишь из субстрата, на который действует данный фермент и окончания «-аза». Так, ферменты, гидролизующие крахмал (амилон), были названы амилазами; ферменты, гидролизующие жиры (липос) - липазами; ферменты, гидролизующие белки (протеины) - протеиназами.
1-й класс: оксидоредуктазы — катализируют окислительно-восстановительные реакции, в которых, как правило, участвуют два субстрата, S и S¢:
Sвоост + S¢окисл → Sокисл + S¢восст.
Процессы окисления могут протекать:
1) с участием кислорода.
В этом случае реакции катализируют ферменты (даны тривиальные названия):
· оксидазы – кислород не внедряется в молекулу субстрата (для простоты представления второй субстрат опущен)
|
|
|
SH2 + l/202 → S + H2O;
· монооксигеназы (гидроксилазы) – в субстрат внедряется один атом молекулы кислорода
HSH + l/202 → HS–OH;
· диоксигеназы – в субстрат внедряются два атома молекулы кислорода
HSH + 02 → НО–S–ОН.
2) без участия кислорода.
Эти реакции катализируют следующие группы ферментов:
· дегидрогеназы – осущестляют дегидрирование (удаление водорода) субстрата
SH2 → S + 2Н;
· редуктазы – осуществляют присоединение водорода к субстрату
S + 2H → SH2;
· цитохромы – осуществляют перенос электронов
a3 (Cu2+) + е – → а3 (Сu1+)
В катализируемых этими ферментами реакциях принимают участие следующие функциональные группы субстратов:
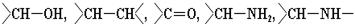
Ниже приведены характеристики ферментов, относящихся к двум подклассам 1-ого класса:
1.1. Ферменты, действующие на спиртовую группу (донор электронов)
1.1.1.1. Алкоголь: NAD+оксидоредуктаза [ алкогольдегидрогеназа ]
Спирт + NAD+ → Альдегид или кетон + NADH + H+
1.4. Ферменты, действующие на амино-группу (донор электронов)
1.4.1.3. L-Глутамат: NAD(P)+оксидоредуктаза (дезаминирующая) [ глутаматдегидрогеназа печени животных]. Аббревиатура NAD(P)+ означает, что акцептором электронов в этом случае может служить либо NAD+, либо NADP+.
L-Глутамат + Н2О + NAD(P)+ → a-Кетоглутарат + NH4+ + NAD(P)H + Н+
2-й класс: трансферазы – катализируют реакции переноса химических групп (отличных от атома водорода) от субстрата-донора на субстрат-акцептор. Названия ферментов этого класса учитывают названия субстрата-донора, переносимой группы с окончанием «-аза». Например, если переносится метильная группа, то к названию субстрата добавляется метилтрансфераза; аминогруппа – добавляется аминотрансфераза; ацильная группа – ацилтрансфераза и т.д. В случае переноса остатка фосфорной кислоты от нуклеозидтрифосфатов на субстрат фермент чаще называют киназой. Примером может служить реакция, катализируемая глюкокиназой:
Глюкоза + АТР → Глюкозо-6-фосфат + АDР
Примеры реакций, катализируемых ферментами некоторых подклассов 2-ого класса:
2.3. Ацилтрансферазы
2.3.1.6. Ацетил-СоА: холин О-ацетилтрансфераза [ холин-ацетил-трансфераза ]
Ацетил-СоА + Холин → СоА + О-Ацетилхолин
2.7. Ферметы, катализирующие перенос группы, содержащей фосфор.
2.7.1.1. АТР: D-гексоза 6-фосфотрансфераза [ гексокиназа ]
АТР + D-Гексоза → АDP + D-Гексозо-6-фосфат
3-й класс: гидролазы – катализируют гидролиз сложных соединений с присоединением по концам расщепляемой связи остатков воды. Названия ферментов часто состоят из названия гидролизуемой связи и окончания «-аза». Например, гидролиз пептидных связей осуществляют пептидазы, гликозидных – гликозидазы, сложные эфиры гидролизуются эстеразами. Ферменты, участвующие в гидролизе эфиров фосфорной кислоты - монофосфатов и дифосфатов, называют фосфатазами и дифосфатазами, соответственно. Примерами служат глюкозо-6-фосфатфосфатаза:
Глюкозо-6-фосфат + Н2О → Глюкоза + H3PO4
и фруктозо-1,6-дифосфатдифосфатаза:
Фруктозо-1,6-дифосфат + Н2О → Фруктозо-6-фосфат + Н3РО4
Для некоторых ферментов-гидролаз сохранились тривиальные названия – амилаза (гидролиз крахмала), липаза (гидролиз жиров).
3.1. Ферменты, действующие на сложноэфирные связи
3.1.1.8. Ацетилхолин–ацилгидролиза [ псевдохолинэстераза ]
Ацилхолин + Н2О → Холин + Кислота.
3.2. Ферменты, действующие гликозильные соединения. Например:
3.2.1.23. b-D-Галактозид-галактогидролаза [ b-галактозидаза ]
b-D-Галактозид + Н2О → Спирт + D-Галактоза.
3.4. Ферменты, действующие на пептидные связи
Классификация этих ферментов (с подразделением на 11 подклассов) учитывает различия между пептидазами и протеиназами, ферментами, гидролизующими ди- или более крупные пептиды, отщепляющими один или более аминокислотных остатков, атакующими пептидные связи с С- или N-концов полипептидов. Протеиназы в соответствии с механизмом катализа подразделяют на тиоловые, металлозависимые, сериновые и карбоксипротеиназы.
|
|
|
3.4.21. Сериновые протеиназы
К сериновым протеиназам относятся химотрипсин, трипсин, эластаза, плазмин, факторы свертывания крови IXa и Xia и др.
3.4.23. Карбокси-(кислые) протеиназы
К карбоксипротеиназам относятся пепсины типов А, В и С.
4-й класс: лиазы – катализируют все реакции негидролитического расщепления химических связей, а также образования новых связей (двойных), не требующих энергии гидролиза АТР. Например, ферменты, катализирующие разрыв связи с выделением углекислого газа, получили название декарбоксилаз, а ферменты осуществляющие удаление воды – дегидратаз.
R–COOH → RH + СО2 (декарбоксилаза)
R–CHOH–CH2–COOH → RCH=СН–СООН + Н2О (дегидратаза)
В случае каталитического присоединения СО2 и Н2О ферменты называют карбоксилазами и гидратазами, соответственно.
4.1.2. Альдегид-лиазы
4.1.2.7. Кетозо-1-фосфат-альдолаза [ альдолаза ]
Фруктозо-1-фосфат → Дигидроксиацетонфосфат + Глицеральдегид
4.2. Углерод-кислород лиазы
4.2.1.2. L-Малат-гидролиаза [ фумараза ]
L-Малат → Фумарат + Н2О.
5-й класс: изомеразы – катализируют реакции взаимопревращения оптическиактивных, геометрических и позиционных изомеров. Примером служит фермент, катализирующий вторую реакцию гликолитического пути расщепления глюкозы - глюкозо-6-фосфатизомераза:
Глюкозо-6-фосфат → Фруктозо-6-фосфат
5.2. Цис-транс-изомеразы
5.2.1.3. все-транс-Ретиналь 11-цис-транс-изомераза [ ретинальизоме-раза ]
все-транс-Ретиналь → 11-цис-Ретиналь
5.3. Ферменты, катализирующие взаимопревращение альдоз и кетоз
5.3.1.1. D-Глицеральдегид-3-фосфаткетол-изомераза [ триозофосфат-изомераза ]
D-Глицеральдегид-3-фосфат → Дигидроксиацетонфосфат.
6-й класс: лигазы – (от лат. лигаре - связывать) катализируют реакции соединения более простых молекул в сложные, сопряженные с распадом АТР. В названии этих ферментов присутствует название продукта реакции с добавлением слова – синтетаза. Например, аминоацил–т-РНКсинтетазы обеспечивают энергозависимую активацию аминокислот с одновременным присоединением последних к молекулам транспортных РНК:
|
|
|
Аминокислота + т-РНК + АТР → Аминоацил-т-РНК + АDР
6.3. Ферменты, катализирующие образование связей С–N
6.3.1.2. L-Глутамат: аммиак лигаза (ADP) [ глутаминсинтетаза ]
АТР + L-Глутамат + NH4+ → ADP + Ортофосфат + L-Глутамин
6.4. Ферменты, катализирующие образование связей С–С
6.4.1.2. Ацетил-СоА: СО2 лигаза (ADP) [ ацетил-СоА-карбоксилаза ]
АТР + Ацетил-СоА + СО2 → ADP + Pi + Малонил-СоА
 2015-05-12
2015-05-12 1065
1065








