|
Плавление и кристаллизации вещества являются фазовым переходом первого рода и для чистых веществ плавление характеризуется определенной температурой, являющейся константой данного вещества.
В противоположность чистым веществам, многокомпонентные смеси кристаллизуются не при одной температуре, а в некотором интервале температур. Поэтому плавление и кристаллизация сплава данной концентрации характеризуется температурами начала и конца кристаллизации, которые сильно зависят от состава сплава.
Для суждения о зависимости температуры кристаллизации расплавов от их состава результаты измерений удобно представить в виде диаграммы состояния. Диаграмма состояния есть графическое изображение изменения равновесного состояния сплавов в зависимости от температуры и концентрации. Очевидно, что внешний вид диаграммы состояния различен для различных комбинаций веществ и будет определяться характером взаимодействия между компонентами сплава.
Простейший вид диаграмма состояния имеет в том случае, когда вещества обладают неограниченной растворимостью как в жидкой, так и в твердой фазе. Таким свойством обладают системы Cu-Ni ; Ag-Au; Вi-Sb и др. Диаграмма состояния таких сплавов (типа сигары) приведена на рис. 1, где по оси ординат нанесены температуры, а по оси абсцисс - концентрации.
Линия аNKb называется линией ликвидуса, линия аМLb - линией солидуса. Выше линии ликвидуса имеется однородная жидкость. Ниже линии солидуса - однородный твердый раствор. Заштрихованная область является областью расслоения на жидкую и твердую фазы. При построении кривой охлаждения сплава концентрации С видно, что она имеет две критические точки К и М (рис. 2), соответствующие началу и концу затвердевания соответственно.
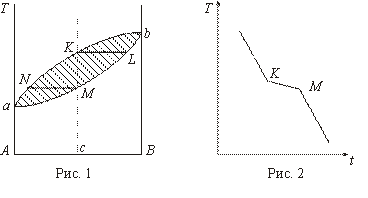
Изменение наклона кривых указывает на наличие температурного интервала, в котором происходит выделение теплоты кристаллизации, в отличие от чистого компонента, у которого выделение теплоты кристаллизации происходит при одной строго определенной температуре.
В том случае, когда вещества обладают неограниченной растворимостью в жидкой фазе и совсем не растворяются друг в друге в твердой (Bi-Cd; Ag-Pb), они образуют диаграмму с наличием эвтектики (рис. 3). На диаграмме точками а и b обозначены температуры затвердевания чистых веществ А и В. Линия аЕb - температуры начала кристаллизации в зависимости от состава смеси (линия ликвидуса). Точка Е, в которой пересекаются обе кривые кристаллизации, называется эвтектической точкой, а кристаллы, выделяющиеся в ней, называются эвтектикой. Эвтектика представляет собой мелкодисперсную смесь кристаллов чистых компонент.

рис. 3
И, наконец, вещества, обладающие неограниченной растворимостью в жидкой и частичной растворимостью в твердой фазе, образуют диаграмму, представленную на рис. 4.
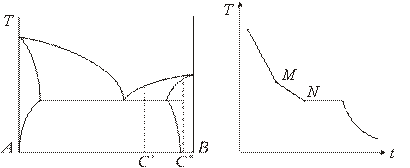
рис.4 рис.5
К таким комбинациям относятся Рb-Bi; Bi-Sn; Pb-Sb.
Для других комбинаций веществ вид диаграмм состояния может быть значительно сложнее.
Рассмотрим процесс затвердевания сплава концентрации 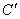 веществ, дающих чисто эвтектическую диаграмму состояния (рис. 3). веществ, дающих чисто эвтектическую диаграмму состояния (рис. 3).
Кривая  , есть кривая изменения температуры начала кристаллизации вещества А в зависимости от его концентрации в расплаве. Поэтому ордината точки М есть температура , есть кривая изменения температуры начала кристаллизации вещества А в зависимости от его концентрации в расплаве. Поэтому ордината точки М есть температура  , при которой из данного расплава начинают выделяться кристаллы вещества А в чистом виде. По мере выпадения кристаллов А расплав становится богаче веществом В, а следовательно выделение кристаллов А должно происходить при более низкой температуре, чем , при которой из данного расплава начинают выделяться кристаллы вещества А в чистом виде. По мере выпадения кристаллов А расплав становится богаче веществом В, а следовательно выделение кристаллов А должно происходить при более низкой температуре, чем  ; действительно, одновременно с кристаллизацией вещества А температура расплава понижается. ; действительно, одновременно с кристаллизацией вещества А температура расплава понижается.
Когда температура расплава достигнет эвтектической температуры (точка N), а концентрация сплава, соответственно концентрации эвтектического сплава (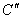 ), начинается затвердевание эвтектики. В процессе затвердевания сплава эвтектической концентрации температура не изменяется. ), начинается затвердевание эвтектики. В процессе затвердевания сплава эвтектической концентрации температура не изменяется.
Кривая зависимости температуры охлаждающегося расплава концентрации 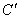 от времени представлена на рис.5. от времени представлена на рис.5.

рис.6 рис.7
Таким образом, кристаллизация сплава начинается при температуре тем более низкой, чем ближе концентрация сплава к эвтектической, и заканчивается при эвтектической температуре. На основании сказанного видно, что для веществ, имеющих чисто эвтектическую диаграмму состояния, линией солидуса является линия KNEL (рис.3).
Для веществ с ограниченной растворимостью кривые охлаждения сплавов концентраций и и  (см. рис. 4) представлены, на рис.6. (см. рис. 4) представлены, на рис.6.
Цель работы состоит в построении диаграммы состояния системы Pb-Sn и определении эвтектической точки.
Хотя диаграмма состояния сплава Pb-Sn и не принадлежит к числу чисто эвтектических (эти вещества обладают небольшой взаимной растворимостью, диаграмма типа рис.4), рабочие концентрации выбраны так, что построение диаграммы для простоты можно вести так же, как и эвтектической.
Выполнение работы.
Для построения диаграммы термическим методом нужно получить кривые охлаждения чистых металлов Pb и Sn и ряда их сплавов.
В расплавленный и немного подогретый металл погружается термопара, подключенная к милливольтметру. Через определенные (15-30 сек) промежутки времени записываются показания милливольтметра. Охлаждение чистого металла идет согласно кривой охлаждения, изображенной на рис. 7, где 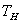 - начальная температура металла, - начальная температура металла, 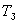 - температура затвердевания металла. - температура затвердевания металла.
При понижении температуры от  к к  показания прибора монотонно уменьшаются. В промежутке времени показания прибора монотонно уменьшаются. В промежутке времени 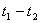 показания прибора остаются неизменными, а затем опять начинают уменьшаться. показания прибора остаются неизменными, а затем опять начинают уменьшаться.
Показание милливольтметра в момент остановки и будет соответствовать температуре затвердевания. При охлаждении сплавов, как было сказано выше, кривая может иметь несколько критических точек (рис. 5,6), которые определяются по месту изменения наклона на кривой охлаждения.
По полученным критическим точкам строится диаграмма состояния свинец – олово и находится эвтектическая точка.
Диаграмма строится следующим образом: по оси абсцисс откладывается процентное содержание исследуемых сплавов, а на ординаты, соответствующие этим сплавам, наносятся найденные критические температуры. Полученные точки соединяются плавными линиями. Минимум кривой дает эвтектическую точку. При небольших разбросах температуры окончания затвердевания исследованных сплавов эта температура находится как среднее арифметическое.
|














