Вода является слабым электролитом, молекулы которого в очень малой степени диссоциируют на ионы (при t» 20 °C на ионы распадается одна из примерно 108 молекул). Процесс диссоциации воды можно записать так:
2H2O «H3O+ + OH–,
где H3O+ – гидроксоний-ион (гидроний-ион), OH– – гидроксид-ион. Данный процесс называется самоионизацией или автопротолизом. В упрощённом виде диссоциацию воды записывают так:
H2O «H+ + OH–,
где H+ – гидрид-ион.
Согласно методу активностей константа диссоциации воды может быть рассчитана по формуле (5.28):
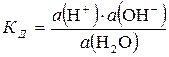 .
.
Учитывая ничтожно малую степень диссоциации воды, константу её диссоциации можно выразить через равновесные концентрации по формуле (5.13):
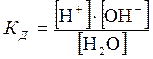 .
.
При этом концентрацию нераспавшихся молекул воды модно считать равной общей концентрации молекул воды. Тогда:
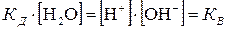 , , | (5.31) |
где KВ – ионное произведение воды (при постоянной температуре является константой).
В любом водном растворе равновесные концентрации ионов H+ и OH– связаны между собой соотношением (5.31). При T = 295,15 K (22 °C) KВ = 10–14. Отсюда в нейтральной среде (например, в чистой воде):
|
|
|
[H+] = [OH–] = 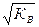 = 10–7
= 10–7 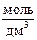 .
.
Если в воду добавить кислоту, концентрация [H+] резко возрастёт. За счёт подавления диссоциации воды равновесие данного процесса сместится влево (в сторону обратной реакции), концентрация [OH–] резко уменьшится. Однако ионное произведение воды KВ останется неизменным. Следовательно, при T = 295,15 K в кислой среде:
[H+] > 10–7 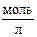 и [OH–] < 10–7
и [OH–] < 10–7 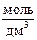 .
.
Соответственно, если в воду добавить основание (щёлочь), резко возрастёт концентрация [OH–], а концентрация [H+] уменьшится. Следовательно, при T = 295,15 K в щелочной среде:
[H+] < 10–7 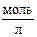 и [OH–] >10–7
и [OH–] >10–7 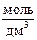 .
.
Для оценки характера среды (нейтральности, кислотности, щёлочности) в 1909 г. С.П.Л. Сёренсеном был введён специальный параметр – водородный показатель pH (от датского potenz – степень и Н – символ водорода). По определению Сёренсена водородный показатель (рН) – это взятый с обратным знаком десятичный логарифм равновесной молярной концентрации ионов водорода в растворе:
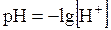 . . | (5.32) |
Например, если [H+] = 10–9 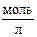 (щелочная среда), то рН = 9. Таким образом, при T = 295,15 K для нейтральной среды:
(щелочная среда), то рН = 9. Таким образом, при T = 295,15 K для нейтральной среды:
[H+] = 10–7 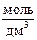 , рН = 7,
, рН = 7,
для кислой среды:
[H+] > 10–7 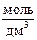 , рН < 7,
, рН < 7,
для щелочной среды:
[H+] < 10–7 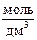 , рН > 7.
, рН > 7.
Следовательно, чем выше концентрация гидрид-ионов, тем меньше рН. В сильнощелочной среде водородный показатель может быть немного больше 14, а в очень кислой среде принимать отрицательные значения.
По аналогии с рН введён показатель рОН:
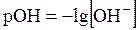 . . | (5.33) |
Например, если [OH–] = 10–9 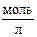 (кислая среда), то рОН = 9. При T = 295,15 K для нейтральной среды:
(кислая среда), то рОН = 9. При T = 295,15 K для нейтральной среды:
[OH–] = 10–7 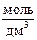 , рОН = 7,
, рОН = 7,
для кислой среды:
[OH–] < 10–7 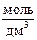 , рОН > 7,
, рОН > 7,
для щелочной среды:
[OH–] >10–7 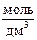 , рОН < 7.
, рОН < 7.
|
|
|
Чем выше концентрация гидроксид-ионов, тем меньше рОН.
Также введён показатель р КВ:
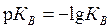 . . | (5.34) |
Из уравнений (5.31, 5.32 – 5.34) следует:
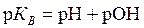 . . | (5.35) |
Таким образом, зная рН, можно легко рассчитать рОН и наоборот.
Для концентрированных растворов сильных электролитов следует использовать не равновесные концентрации [H+], [OH–] и [H2O], а активности a (H+), a (OH–) и a (H2O). Тогда выражения (5.31 – 5.33) примет соответственно вид:
| КД × a (H2O) = a (H+)× a (OH–) = КВ, | (5.36) | |
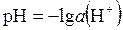 , , | (5.37) | |
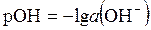 . . | (5.38) |
При малых концентрациях H+ и OH–, а также в растворах слабых электролитов любых концентраций значения концентрации и активности практически совпадают, в этом случае для приближённых расчётов можно использовать формулы (5.31 – 5.33).
Пример 5.4. При T = 295,15 K в водном растворе соляной кислоты равновесная концентрация гидрид-ионов [H+] = 10–3 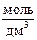 . Каково значение рОН в этом растворе?
. Каково значение рОН в этом растворе?
Решение:
По формуле (5.32) рассчитаем водородный показатель: рН = –lg[H+] = –lg(10–3) = 3.
Учитывая, что при T = 295,15 K ионное произведение воды KВ = 10–14, из формулы (5.35) выразим рОН: рОН = р КВ – рН = –lg(10–14) – 3 = 14 – 3 = 11.
Ответ: pOH = 11.
рН раствора определяют индикаторным или потенциометрическим методами. Индикаторный метод основан на применении кислотно-основных индикаторов (от позднелат. indicator – указатель) – веществ, изменяющих свою окраску в зависимости от рН раствора. Обычно индикаторами являются слабые кислоты или слабые основания. Рассмотрим индикатор, представляющий собой слабую кислоту, имеющую формулу общего вида HInd. По теории Оствальда при растворении в воде между этой слабой кислотой и сопряжённым ей основанием устанавливается равновесие:
HInd (р. кислоты, окраска А) + H2O(ж.) «H3O+(р.) + Ind– (р. основания, окраска В)
или в упрощённом виде:
HInd (р. кислоты, окраска А) «H+(р.) + Ind– (р. основания, окраска В).
В качестве индикатора используется такая кислота, окраска которой (А) заметно отличается от окраски сопряжённого ей основания (В). При низких значениях рН концентрация иона H+ в растворе высока, следовательно равновесие данной обратимой реакции сдвинуто влево, равновесный раствор имеет окраску А. При высоких значениях рН концентрация H+ в растворе мала, равновесие сдвинуто вправо, раствор имеет окраску В. Примером индикатора, в водном растворе которого устанавливается равновесие данного типа, является фенолфталеин (рис. 5.3). Фенолфталеин – это бесцветная слабая кислота, которая при растворении в воде образует анионы, имеющие пурпурную окраску. В кислой среде равновесие между кислотой и её анионом сдвинуто влево. Концентрация анионов оказывается настолько низкой, что их пурпурная окраска незаметна. Однако в щелочной среде равновесие сдвигается вправо, концентрация анионов становится достаточной, для того, чтобы обнаружилась их пурпурная окраска.
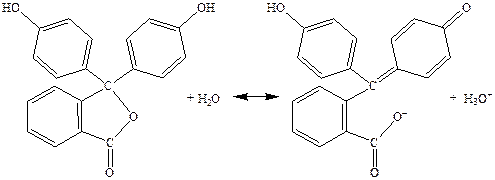 | |
| Бесцветная форма (кислота) | Пурпурная форма (основание) |
Рис. 5.3. Фенолфталеин в водном растворе
Согласно закону действующих масс (5.13) константа диссоциации индикатора:
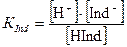 .
.
Так как в точке перехода окраски раствора [HInd] = [Ind–], получим:
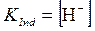 . . | (5.38) |
Значение рН раствора в точке перехода окраски индикатора обозначается p KInd. Таким образом, p KInd – это такое значение рН, при котором половина индикатора находится в форме кислоты, а половина – в форме сопряжённого ей основания.
В действительности наблюдаемое изменение окраски от А к В происходит в некотором диапазоне изменения значений рН, называемом интервал перехода окраски индикатора DрН. Для большинства индикаторов DрН = p KInd ± 1. В таблице 5.1 указаны свойства некоторых кислотно-основных индикаторов.
Для приблизительной оценки рН раствора применяют универсальный индикатор (смесь кислотно-основных индикаторов, позволяющая определить значение рН в диапазоне от 1 до 10 с точностью до единицы рН). Окраска универсального индикатора изменяется от красной (рН < 3,4) через оранжевую (рН 3,4 – 4,7), жёлтую (рН 4,7 – 6,2), зелёную (рН 6,2 – 7,2), голубую (рН 7,2 – 8,5) до фиолетовой (рН > 8,5). Универсальный индикатор обычно нанесён на бумагу, которую смачивают исследуемым раствором и сравнивают полученную окраску с прилагаемой колориметрической шкалой рН. Индикаторный метод позволяет быстро, но очень приблизительно оценить рН исследуемого раствора, им нельзя определить рН мутных и окрашенных растворов.
|
|
|
Таблица 5.1.
Свойства некоторых кислотно-основных индикаторов [БХС, Химия БЭС, Карапетьянц]
| Индикатор | Окраска | p KInd | DрН | |
| в кислой среде | в щелочной среде | |||
| Метиловый оранжевый | красная | оранжево-жёлтая | 3,46 | 3,2 – 4,4 |
| Метиловый красный | красная | жёлтая | 5,00 | 4,8 – 6,0 |
| Лакмус | красная | синяя | 7,00 | 6,0 – 8,0 |
| Фенолфталеин | бесцветный | пурпурный | 9,50 | 8,2 – 10,0 |
| Индиго карминовый | голубой | жёлтый | 11,6 – 14,0 |
В потенциометрическом методе применяют электрод, потенциал которого зависит от концентрации (активности) ионов H3O+. Обычно в качестве такого электрода используют стеклянный электрод, действие которого основано на свойстве тонкой стеклянной мембраны обменивать ионы Na+ на ионы H3O+. Стеклянный электрод в паре с электродом сравнения вводят в исследуемый раствор и измеряют электродвижущую силу (ЭДС) образовавшегося гальванического элемента (стеклянный электрод – раствор электролита – электрод сравнения). ЭДС измеряют с помощью вольтметра (иономера), шкала которого отградуирована в единицах рН. Для более точных измерений рН вместо стеклянного электрода используют водородный электрод. С помощью потенциометрического метода можно определить рН мутных, окрашенных и любых других водных растворов в диапазоне от 0 до 14 с точностью (до 0,01 ед. рН).
 2015-05-26
2015-05-26 1737
1737
