Подавляющее большинство веществ обладают ограниченной растворимостью в воде и других растворителях. Когда растворяемое вещество больше не может растворяться в растворителе образуется насыщенный раствор. Если растворяемое вещество является электролитом (вещество с ионной или ковалентной полярной связью), то его ионы в растворе находятся в динамическом равновесии с кристаллами осадка. Скорость процесса растворения осадка будет равна скорости обратного процесса кристаллизации. Так, для насыщенного раствора электролита Кn+Аn–, находящегося в равновесии с его твёрдой фазой, будет характерен следующий обратимый процесс:
| Кn+Аn– | 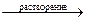
| n+Кz+ + n–Az–. |
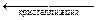
|
Данный процесс является гетерогенным, т.к. протекает на поверхности кристаллов осадка. Т.к. в выражение для константы равновесия KC активность вещества в твёрдой фазе не входит (см. §3.5), KC (т.е. константа диссоциации электролита Кn+Аn– по последней ступени КД) будет определяться только произведением активностей ионов Кz+ и Az– в растворе. Тогда уравнение (5.28) для обратимого процесса «растворение – кристаллизация» примет вид:
| KC = KД = a+n+ × a – n–. | (5.39) |
В данном случае константу равновесия (диссоциации) называют произведением растворимости электролита. Таким образом, произведение растворимости электролита ПР – это постоянная величина, равная произведению активностей ионов электролита, содержащихся в его насыщенном растворе при данной температуре:
| ПР(Кn+Аn–) = a+n+ × a – n–. | (5.40) |
Произведение растворимости применяют для малорастворимых электролитов, концентрация насыщенных растворов которых незначительна. Поэтому для расчёта ПР вместо активностей можно использовать равновесные концентрации ионов электролита:
| ПР(Кn+Аn–) = [ Кz+ ] n+ × [ Az –] n–. | (5.41) |
ПР малорастворимых электролитов приведены в справочника при стандартной температуре 298,15 К (25 °С) [Лурье]. Чем меньше величина ПР (т.е чем меньше константа равновесие в системе «осадок – раствор»), тем в меньшей степени осуществляется растворение вещества. Исходя из ПР электролита, можно установить, выпадет ли данный электролит в осадок или нет. Если произведение концентраций ионов электролита меньше его произведения растворимости, то раствор является ненасыщенным (при введении в него кристаллов электролита они будут растворяться), если равно – насыщенным, если больше - пересыщенным (из раствора выпадает осадок кристаллов электролита):
| СМ(Кz+)n+ × СМ(Az–)n– < ПР(Кn+Аn–) | – ненасыщенный раствор, растворение кристаллов; |
| СМ(Кz+)n+ × СМ(Az–)n– = ПР(Кn+Аn–) | – насыщенный раствор; |
| СМ(Кz+)n+ × СМ(Az–)n– > ПР(Кn+Аn–) | – пересыщенный раствор, выпадение осадка. |
 2015-05-26
2015-05-26 407
407








