5.4.1. Теория сольвосистем. Начало данной теории положили работы американских химиков Кэди и Франклина, опубликованные в 1896 – 1905 гг. Согласно теории сольвосистем, кислотой является соединение, дающее в растворе те положительные ионы, которые образуются при собственной диссоциации растворителя. В частности, в водных растворах дающее гидрид-ионы H+. Например, азотная (HNO3) и серная (H2SO4) кислоты:
HNO3 ® H+ + NO3–,
H2SO4 ® 2H+ + SO42–.
Основанием является соединение, дающее в растворе те отрицательные ионы, которые образуются при собственной диссоциации растворителя. В частности, в водных растворах, дающее гидроксид-ионы OH–. Например, гидроксиды аммония (NH4OH) и кальция (Ca(OH)2):
NH4OH ® NH4+ + OH–,
Ca(OH)2 ® Ca 2+ + 2OH–.
Соединения, способные в зависимости от условий в растворе давать как положительные, так и отрицательные ионы, образующиеся при собственной диссоциации растворителя, называются амфотерными. В частности, в водных растворах амфотерное соединение способно давать как ионы H+, так и ионы OH–. Например, гидроксиды цинка (Zn(OH)2), алюминия (Al(OH)3), свинца (Pb(OH)2), олова (Sn(OH)2), хрома (Cr(OH)3) и др.:
[Zn(OH)4]2– + 2H+ «Zn(OH)2 + 2H2O «[Zn(H2O)2]2+ + 2OH–.
Амфотерные соединения (оксиды и гидроксиды) с кислотами реагируют, как основания, а с основаниями – как кислоты:
Zn(OH)2 + H2SO4 ® ZnSO4 (сульфат цинка) + 2H2O,
при сплавлении:
Zn(OH)2 + 2NaOH ® Na2ZnO2 (цинкат натрия) + 2H2O,
в водном растворе:
Zn(OH)2 + 2NaOH ® Na2[Zn(OH)4] (тетрагидроксоцинкат натрия).
Теорию сольвосистем можно применить не только к водным растворам, но и к растворам других растворителей, в частности аммиака NH3 (при атмосферном давлении газообразный аммиак превращается в жидкость при –33 °С). Собственная диссоциация жидкого аммиака происходит аналогично диссоциации (автопротолизу) воды (см. §5.3):
2NH3 «NH4+ + NH2–,
где ион аммония NH4+ – аналог иона гидроксония H3O+, а ион NH2– – аналог гидроксид-иона OH–.
Таким образом, в аммиачном растворе кислотами являются соединения, дающие ион NH4+ – аммонийные соли. Например, нитрат аммония NH4NO3:
NH4NO3 «NH4+ + NO3–.
Основаниями в аммиачном растворе являются соединения, дающие ион NH2– – амиды металлов. Например, амид калия KNH2:
KNH2 «K+ + NH2–.
Фенолфталеин в аммиачном растворе аммонийной соли бесцветен, в растворе амида металла приобретает пурпурный цвет. Реакция аммонийной соли и амида металла в аммиачном растворе является реакцией нейтрализации, идущая с образованием соли и растворителя (аммиака):
NH4NO3 + KNH2 ® KNO3 (соль) + 2NH3 (растворитель).
Амфотерные амиды в аммиачных растворах способны давать как ионы NH4+, так и ионы NH2–. Амфотерность среди амидов гораздо более распространена, чем среди гидроксидов. Например, амфотерны не только амид цинка Zn(NH2)2 (аналог Zn(OH)2), но и амиды стронция Sr(NH2)2 и натрия NaNH2 (аналоги неамфотерных Sr(OH)2 и NaOH):
[Zn(NH2)4]2– + 2NH4+ «Zn(NH2)2 + 4NH3 «[Zn(NH3)4]2+ + 2NH2–.
Амфотерные амиды реагируют с аммонийными солями как основания, а с амидами металлов – как кислоты:
Zn(NH2)2 + 2NH4NO3 ® Zn(NO3)2 + 4NH3,
Zn(NH2)2 + 2KNH2 ® K2[Zn(NH2)4].
5.4.2. Протонная теория. Данная теория была предложена в 1923 г. датским физико-химиком Иоханнесом Николаусом Бренстедом (1879 – 1947 гг) и Томасом Мартином Лоури. Согласно протонной теории кислотой является частица (молекула или ион), способная отдавать протон H+, а основанием является частица, способная принимать протон. Например, реакцию фторида водорода HF и аммиака NH3 можно записать обратимым уравнением:
HF + NH3 «F– + NH4+.
В прямой реакции HF является кислотой (отдаёт протон), а NH3 основанием (принимает протон). В обратной реакции F– – основание (принимает протон), NH4+ – кислота (отдаёт протон). Таким образом, взаимодействие между кислотой и основанием согласно протонной теории можно описать схемой:
Кислота1 + Основание2 «Основание1 + Кислота2.
Соотношение между кислотой и основанием выражается схемой:
Кислота «Основание + H+.
Кислота и основание, связанные данным соотношением, называются сопряжёнными. В частности, HF – это кислота, сопряжённая основанию F–, а NH4+ – кислота, сопряжённая основанию NH3.
В зависимости от партнёра то или иное вещество может быть либо кислотой, либо основанием. Например, вода по отношению к аммиаку является кислотой:
H2O + NH3 «OH– + NH4+,
а по отношению к фториду водорода – основанием:
H2O + HF «H3O+ + F–.
Таким образом, согласно протонной теории вода является амфотерным веществом (точнее амфипротонным – способным в одних случаях отдавать, а в других принимать протон).
Обратим внимание, что в протонной теории кислотами и основаниями могут быть не только нейтральные частицы – молекулы, но и ионы; основания могут не содержать группу OH–.
5.4.3. Электронная теория. Данная теория была предложена в 1924 г. Г. Льюисом. Согласно электронной теории основанием является соединение, поставляющее электронные пары для образования химической связи (донор электронных пар), а кислотой – соединение, принимающее электронные пары (акцептор электронных пар). Такие соединения называют соответственно льюисовыми основаниями и льюисовыми кислотами. Кислотно-основное взаимодействие по электронной теории заключается в образовании донорно-акцепторной связи, в результате чего образуются солеподобные вещества, называемые аддуктами. Например, реакцию между кислотой HF (акцептором) и основанием NH3 (донором) можно записать так:
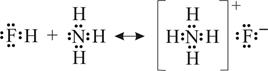 .
.
Аддуктом в этой реакции является соль фторид аммония NH4F.
В приведённом выше примере льюисовым основанием является аммиак – соединение, не включающее группу OH–. Льюисовы кислоты также могут не включать протон H+ (такие кислоты называют апротонными в отличие от водородных) Например, в реакции между трифторидом бора BF3 и аммиаком NH3:
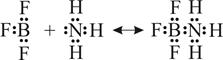
апротонной кислотой является BF3 (акцептор), а основанием NH3 (донор). В результате реакции образуется аддукт – комплексное соединение трифторид амминбора [B(NH3)]F3. Таким образом, электронная теория значительно расширяет круг кислотно-основных реакций, включая в них реакции, приводящие к образованию комплексных соединений. Приведём ещё один пример – реакцию между льюисовой апротонной кислотой хлоридом серебра AgCl (акцептором) и льюисовым основанием аммиаком NH3 (донором):
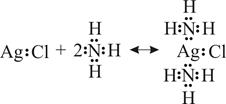 .
.
Аддуктом в данной реакции является комплексное соединение хлорид диамминсеребра [Ag(NH3)2]Cl.
Различные теории кислот и оснований не опровергают, а взаимно дополняют друг друга.
 2015-05-26
2015-05-26 2258
2258
