Статистические и динамические закономерности - две осн. формы закономерной связи явлений, которые отличаются по характеру вытекающих из них предсказаний. В законах динамич. типа предсказания имеют точно определённый, однозначный характер. Так, в механике, если известен закон движения тела и заданы его координаты и скорость, то по ним можно точно определить положение и скорость движения тела в любой др. момент времени. Динамич. законы характеризуют поведение относительно изолированных систем, состоящих из небольшого числа элементов и в которых можно абстрагироваться от целого ряда случайных факторов.
В статистич. законах предсказания носят не достоверный, а лишь вероятностный характер. Подобный характер предсказаний обусловлен действием множества случайных факторов, которые имеют место в статистич. коллективах или массовых событиях (напр., большого числа молекул в газе, особей в биологич. популяциях, людей в социальных коллективах). Статистич. закономерность возникает как результат взаимодействия большого числа элементов, составляющих коллектив, и поэтому характеризует не столько поведение отд. элемента, сколько коллектива в целом. Необходимость, проявляющаяся в статистич. законах, возникает вследствие взаимной компенсации и уравновешивания множества случайных факторов.
Абсолютизация динамич. законов тесно связана с концепцией механич. детерминизма, сторонники которой (П. Лаплас и др.) рассматривали Вселенную как огромную механич. систему и экстраполировали законы динамики Ньютона на все процессы и явления мира. Лаплас утверждал, что если бы были известны такие законы для всех явлений, то можно было бы обнять в одной формуле движения как величайших тел, так и лег-чайших атомов.
Статистич. законы хотя и не дают однозначных и достоверных предсказаний, тем не менее являются единственно возможными при исследовании массовых явлений случайного характера. Критикуя механич. детерминизм, Ф. Энгельс указывал, что случайное не может быть безразличным для науки. Вместе с тем он подчёркивал, что случайное требует иного подхода, ибо изучить всю сеть каузальных отношений, даже с горошинами в стручке, наука совершенно не в состоянии: «... такая наука, которая взялась бы проследить случай с этим отдельным стручком в его каузальном сцеплении со все более отдаленными причинами, была бы уже не наукой, а простой игрой».
За совокупным действием различных факторов случайного характера, которые практически невозможно охватить, статистич. законы вскрывают нечто устойчивое, необходимое, повторяющееся. Статистические законы служат подтверждением диалектики превращения случайного в необходимое. Динамич. законы оказываются предельным случаем статистических, когда вероятность становится практич. достоверностью.
С помощью динамич. законов обычно формулируются каузальные (причинные) связи явлений. Рассматривая одно явление как причину другого, мы вырываем их из всеобщей связи, изолируем друг от друга и тем самым значительно упрощаем и идеализируем действительность. Подобную идеализацию легче осуществить в механике, астрономии, классич. физике, которые имеют дело с точно известными силами и законами движения тел под их воздействием. В более сложных ситуациях приходится учитывать воздействие множества случай-ных факторов и обращаться к статистич. законам.
Вероятность (вероятностная мера) — Численная мера степени объективной возможности наступления случайного события. Оценкой вероятности события может служить частота его наступления в длительной серии независимых повторений случайного эксперимента. Согласно определению П. Лапласа мерой вероятности называется дробь, числитель которой есть число всех благоприятных случаев, а знаменатель — число всех равновозможных случаев.
Вероятность — мера, заданная на измеримом пространстве (Ω, X):
1. 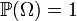
2. 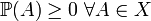
3. обладает свойством сигма-аддитивности (счетной аддитивности)
23. А томная гипотеза (молекулярно-кинетическая теория)
Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений.
Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. Основываясь на законе кратных отношений, открытом в 1803 г., и законе постоянства состава, Дальтон разработал свою атомно-молекулярную теорию, изложенную в вышедшем в1808 г. труде "Новая система химической философии".
Основные положения теории Дальтона состояли в следующем:
1. Все вещества состоят из большого числа атомов (простых или сложных) (размеры атомов (молекул) равны 10-10 - 10-9 м. Число атомов (молекул) в единице объема вещества (твердого тела или жидкости) порядка 1022 частиц в 1 см3)
2. Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
3. Атомы различных элементов способны соединяться между собой в определённых соотношениях.
4. Важнейшим свойством атомов является атомный вес.
Уже в 1803 г. в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений; в качестве точки отсчёта Дальтон выбрал атомный вес водорода, принятый равным единице. Для обозначения атомов элементов Дальтон использовал символы в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения атомных весов.
Таблица Дальтона стала первым шагом на долгом пути, который предстояло пройти химии для того, чтобы величины атомных масс приняли привычные для нас значения. Разрешение проблемы определения атомных весов, потребовавшее усилий многих выдающихся учёных, заняло более пятидесяти лет! И даже после того, как проблема была в основном решена, точное определение атомным масс оставалось настолько важной задачей, что в 1914 г. американский учёный Теодор Ричардс был удостоен Нобелевской премии за уточнение атомных масс некоторых элементов.
24. Первое и второе начало термодинамики
Первое начало термодинамики — одно из основных положений термодинамики, являющееся, по существу, законом сохранения энергии в применении к термодинамическим процессам.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ Ю. Р. Майера, Джоуля и Г. Гельмгольца. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя 1-го рода, который совершал бы работу, не черпая энергию из какого-либо источника.
1) Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
2) Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе и не зависит от способа, которым осуществляется этот переход.
Первый закон (первое начало) термодинамики можно сформулировать так:
«Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщённого системе, в сумме с изменением энергии, связанной с количеством вещества N при химическом потенциале μ, и работы A', совершённой над системой внешними силами и полями, за вычетом работы A, совершённой самой системой против внешних сил»:
ΔU = Q − A + μΔN + A'.
Второе начало термодинамики один из основных законов термодинамики, закон возрастания энтропии: в замкнутой, т. е. изолированной в тепловом и механическом отношении, системе энтропия либо остается неизменной (если в системе протекают обратимые, равновесные процессы), либо возрастает (при неравновесных процессах) и в состоянии равновесия достигает максимума. Другие эквивалентные формулировки:
1. невозможен переход теплоты от тела более холодного к телу более нагретому без каких-либо других изменений в системе или окружающей среде (Р. Клаузиус);
2. невозможно создать периодически действующую (совершающую какой-либо термодинамический цикл) машину, вся деятельность которой сводилась бы к поднятию некоторого груза (механической работе) и соответственно охлаждению теплового резервуара (У. Томсон, М. Планк);
3. невозможно построить вечный двигатель 2-го рода (В. Оствальд).
4. невозможна самопроизвольная передача теплоты от холодного тела к теплому.
никакой двигатель не может преобразовывать теплоту в работу со стопроцентной эффективностью.
в замкнутой системе энтропия не может убывать.
 2015-05-26
2015-05-26 1353
1353








