Лекция 5
Для реакций, не сопровождающихся переносом электронов, нет общепринятого термина. К наиболее широкой группе таких реакций относятся реакции ионного обмена в водных растворах. В подавляющей своей части эти реакции обратимы и протекают при посредничестве воды. Электролит (вещество, распадающееся в растворах или расплавах на ионы) при растворении в воде нередко реагирует с ней, приводя к изменению ее кислотности.
Согласно протонной теории кислот и оснований, выдвинутой Й.Н.Бренстедом и Т.М.Лоури, кислотой является соединение, отщепляющее в реакции протоны, а основанием – соединение, способное принимать протоны. Любая реакция отщепления протона выражается уравнением: кислота 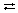 основание + Н+.
основание + Н+. 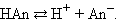 Пользуясь данными определениями, по внешнему виду формулы молекулы ее можно отнести либо к кислотам, либо к основаниям. Недостаток такого подхода состоит в том, что имеются вещества, в которых нет гидроксильных групп, но в растворах они дают основную среду (NH3). Не всегда по формуле соединения удается определить – кислота это или основание. Например, формулу борной кислоты записывают двумя способами: Н3BO3 и B(OH)3.
Пользуясь данными определениями, по внешнему виду формулы молекулы ее можно отнести либо к кислотам, либо к основаниям. Недостаток такого подхода состоит в том, что имеются вещества, в которых нет гидроксильных групп, но в растворах они дают основную среду (NH3). Не всегда по формуле соединения удается определить – кислота это или основание. Например, формулу борной кислоты записывают двумя способами: Н3BO3 и B(OH)3.
C точки зрения химического строения нет принципиального различия между кислородсодержащими кислотами и основаниями – все эти соединения вполне обоснованно можно назвать гидроксидами. И в тех, и в других существует один и тот же порядок связей: водород–кислород–элемент. Отличие состоит в том, что одни в водных растворах отщепляют протон Н+, а другие – гидроксид-ион НО–. Ответ на вопрос, почему возникают такие различия, дает анализ электроотрицательностей атомов, образующих соединения.
На самом деле свободные протоны не могут существовать в растворе несвязанными и переходят от кислоты к основанию, образуя сопряженное основание и сопряженную кислоту. Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
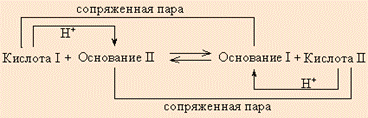
Например:

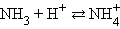
Уксусная кислота, отдав протон, превращается в основание (получившее название «сопряженное»). Аммиак, приняв протон, из основания превращается в сопряженную кислоту. Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам.
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
Наиболее общей считается теория кислот и оснований Г.Н.Льюиса, который допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно Льюису, кислотой является соединение, принимающее электронную пару, а основанием – предоставляющее электронную пару. Так в реакции AlF3 +:NH3 = F3Al:NH3 атом алюминия принимает неподеленную электронную пару атома азота на свою вакантную электронную орбиталь. При взаимодействии донора электронной пары:NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи. Ни кислота, ни основание протонов не содержат.
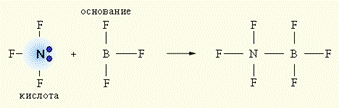
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
Вода, являясь слабым электролитом и обычным растворителем, участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
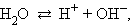
ее константа при 298 K равна
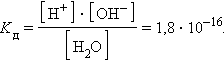
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
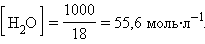
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
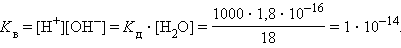
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной. window.top.document.title = "6.4.1. Водородный показатель pH"; Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+]. Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14. Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Например, если точно известно, какое количество гидроксида натрия (в граммах или моль) израсходовано в реакции с соляной кислотой, то по уравнению реакции NaOH + HCl = NaCl + H2O легко рассчитать, сколько граммов (или моль) хлороводорода было в анализируемом растворе. Подобные расчеты можно проводить только для стехиометрических реакций (stoicheion – основание, элемент и metreo – измеряю), что означает измерение соотношений, в которых химические элементы реагируют друг с другом. А проделываются подобные измерения методом титрования (от франц. titre – качество, характеристика) – одим из методов количественного анализа, основанным на измерении количества реагента, который полностью реагирует с анализируемым веществом (см. лаб. работу).
 2015-05-26
2015-05-26 764
764







