СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Константа и степень диссоциации слабого электролита
Кравновесию, которое устанавливается в растворе слабого электролита между ионами и молекулами можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации типичного слабого электролита — уксусной кислоты CH3COOH 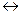 H+ + CH3COO- константа равновесия КС, выраженная через молярные концентрации реагентов (
H+ + CH3COO- константа равновесия КС, выраженная через молярные концентрации реагентов (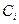 ), имеет вид:
), имеет вид:
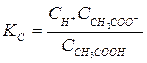 . (1)
. (1)
Константа равновесия диссоциации слабого электролита называется константой диссоциации (К). Величина К зависит от природы электролита и растворителя, а также от температуры. Термодинамическая константа диссоциации, выраженная через активность ионов и молекул, не зависит от концентрации. Вычисленная практическая константа диссоциации (К) может изменяться с изменением концентрации. Поэтому для сравнения значения практической константы диссоциации со справочным при заданной температуре, рассчитанные для разных концентраций, усредняются.
|
|
|
Константа диссоциации характеризует способность данного электролита распадаться на ионы в растворе. Чем больше К, тем полнее диссоциирует электролит в растворе.
Получим в наиболее общем виде выражение для константы диссоциации слабого электролита (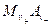 ) через его начальную концентрацию (С) и степень диссоциации (α), исходя из следующей схемы диссоциации, соответствующей суммарному равновесию:
) через его начальную концентрацию (С) и степень диссоциации (α), исходя из следующей схемы диссоциации, соответствующей суммарному равновесию:
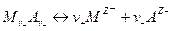 . (2)
. (2)
Константа диссоциации этого суммарного процесса равна:
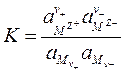 , (3)
, (3)
где 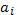 — равновесные активности компонентов. Выразим их через соответствующие коэффициенты активности (
— равновесные активности компонентов. Выразим их через соответствующие коэффициенты активности (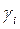 ):
):
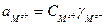 ;
; 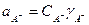 ;
; 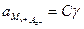 . (4)
. (4)
Для разбавленных растворов 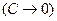 ,
, 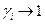 , тогда
, тогда 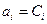 , где
, где 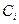 — равновесные концентрации компонентов. В этом случае для начальной молярной концентрации электролита С м (моль/л) равновесные концентрации компонентов с учетом степени диссоциации будут равны:
— равновесные концентрации компонентов. В этом случае для начальной молярной концентрации электролита С м (моль/л) равновесные концентрации компонентов с учетом степени диссоциации будут равны:
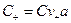 ;
; 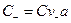 ;
; 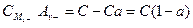 . (5)
. (5)
С учетом вышеизложенного из (3) получим:
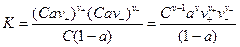 . (6)
. (6)
Приведем примеры.
CH3COOH  H+ + CH3COO-
H+ + CH3COO-
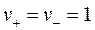 ;
; 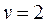
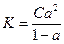 .
.
Это уравнение для константы диссоциации выражает закон разведения Оствальда.
Слабые электролиты, для которых ν > 2, в меньшей степени отвечают условию (4) вследствие возрастания сил ионного взаимодействия, кроме того, в этих случаях процесс диссоциации может протекать в несколько стадий, каждая из которых имеет свое значение К.
Например, угольная кислота диссоциирует в две ступени:
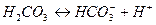
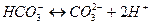 .
.
Константа диссоциации (равновесия)
по 1-ой ступени – 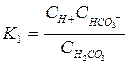 ,
,
по 2-ой ступени – 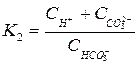 .
.
Суммарному равновесию соответствует константа - диссоциации:
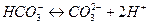
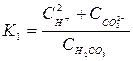 .
.
При этом выполняется соотношение 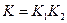 и, как правило,
и, как правило, 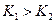 .
.
Из (5) константа диссоциации для этого типа электролитов рассчитывается по уравнению:
|
|
|
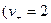 ;
; 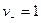 ;
; 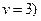
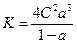 .
.
Расчет константы диссоциации электролитов, для которых ν > 3, из кондуктометрических измерений, по причинам, изложенным выше, приведет к значительным ошибкам, поэтому проводить его в этом случае, на наш взгляд, нецелесообразно.
Решая уравнение (6) относительно α, получим:
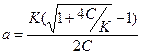 . (7)
. (7)
Уравнение (7) позволяет рассчитывать степень диссоциации (α) по известному значению константы диссоциации слабого электролита для различных концентраций. Для малых значений α, когда 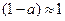 , уравнение (6) принимает вид
, уравнение (6) принимает вид 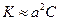 , или
, или 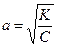 .
.
То есть степень диссоциации уменьшается при возрастании концентрации раствора слабого электролита. Объясняется это тем, что разбавление раствора не препятствует прямому процессу в равновесии (распаду молекул), но затрудняет обратный процесс образования молекул из ионов при их столкновении. Значения констант диссоциации электролитов приводятся в справочниках. Например, для уксусной кислоты при 298 К 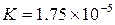 .
.
Для процесса диссоциации воды:
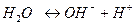
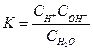 . (8)
. (8)
Концентрация воды (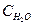 ) в водных растворах остается практически постоянной, так как вода диссоциирует на ионы очень слабо.
) в водных растворах остается практически постоянной, так как вода диссоциирует на ионы очень слабо.
Из (8) получаем
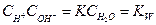 .
.
Величину КW называют ионным произведением воды. В чистой воде при 25  C
C 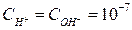 моль/л, поэтому
моль/л, поэтому 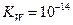 .
.
При увеличении температуры 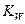 заметно растет и при 100
заметно растет и при 100  С достигает
С достигает 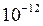 .
.
Температурная зависимость константы диссоциации выражается уравнением изобары реакции:
Эти уравнения выражают зависимость константы равновесия реакции от температуры и в дифференциальном виде имеют вид:
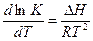 .
.
Если тепловой эффект реакции положителен 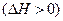 , то
, то 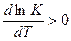 .
.
Это значит, что с ростом температуры константа равновесия
эндотермической реакции всегда увеличивается, следовательно, увеличивается α — степень диссоциации электролитов. Если 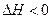 , то
, то 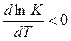 . В этом
. В этом
случае с ростом температуры константа диссоциации уменьшается, следовательно, уменьшается и α.
 2015-05-26
2015-05-26 16448
16448