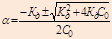Слабые электролиты (a < 1)
слабые электролиты – вода, водные растворы многих неорганических и органических кислот, оснований р -, d - и f -элементов
Для расчета используют основные положения теории Аррениуса: к обратимому процессу диссоциации может быть применен закон действующих масс. Константа равновесия КС называется константой диссоциации.
Чем меньше К Д в данном растворителе, тем слабее диссоциирует электролит.
Для процесса диссоциации слабой кислоты НА Û Н+ + А-
константа диссоциации кислоты К д 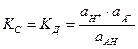
g ≈1 (взаимодействие слабое) Þ а =g × с = с Þ 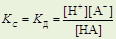
где [H+] – равновесная концентрация Н+
Для процесса диссоциации слабого основания RОН Û R+ + ОН-
константа диссоциации основания К д 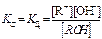
Зависимость a от концентрации слабого электролита
Диссоциация муравьиной кислоты: НСООН Û НСОО- + Н+.
(1 - a)со aсо aсо
со - исходная концентрация кислоты
a - степень диссоциации,
| НСООН | НСОО- | Н+ | |
| Сисх | со | ||
| DС | aсо | aсо | aсо |
| Сравн | со - aсо | aсо | aсо |
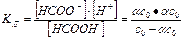 КД = 1,77×10-4 при t = 25° С.
КД = 1,77×10-4 при t = 25° С.
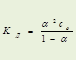 закон разведения Оствальда
закон разведения Оствальда
Если a << 1, то К Д» a2 со - приближенная формула закона Оствальда
тогда 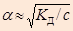 для расчетов с Кд < 10-4
для расчетов с Кд < 10-4
ВЫВОД: a - уменьшается с увеличением концентрации.
Многоосновные слабые кислоты (H2SO3, H2CO3 и т.д.) и многокислотные основания (Zn(OH)2, Al(OH)3 и т.д.) диссоциируют ступенчато:
1-ая ступень Zn(ОН)2 Û ZnОН+ + ОН- К Д1 = 4,4×10-5.
2-ая ступень ZnОН+ Û Zn2+ + ОН- К Д2 = 1,5×10-9.
· Константа диссоциации по каждой последующей ступени всегда на несколько порядков ниже, чем предыдущей: К Д2 << К Д1
· К Д зависит
- от природы диссоциирующего вещества и растворителя (чем меньше КД, тем устойчивее частица),
- от температуры: с Т↑обычно К Д↓ (∆Н < 0)
· К Д не зависит от концентрации раствора.
· величины К Д – табулированы при 250 С.
Сильные электролиты (a = 1)
В водных растворах сильные электролиты -почти все соли, щелочи (гидроксиды s -металлов, кроме Be(OH)2 Mg(OH)2), кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4…
Сильные электролиты диссоциируют полностью, необратимо (нет нераспавшихся частиц):
Ba(OH)2 ® Ba2+ + 2OH-
Al2(SO4)3 ® 2Al3+ + 3SО42-
Þ с ионов большая Þ свойства растворов зависят от взаимодействия ионов друг с другом и с Н2О. g ≠ 1
П.Дебай и Э.Хюккель (1923г.) – понятие ионной атмосферы: каждый ион окружен противоположно заряженными ионами, каждый ион - центр своей ионной атмосферы; в очень концентрированных растворах – ионные пары
При расчете растворов сильных электролитов все основные параметры раствора выражают как функцию суммарного взаимодействия атмосфер с центральными ионами. Энергия этого взаимодействия ↑ при ↑ С и при ↓ Rатм и при ↑плотности заряда атмосферы. В расчетах вместо С используют активность а =g×с
g ± - средний коэффициент активности электролита (определяют экспериментально).
Для электролита А n В m → nАm+ + mВ n-
g ± = среднее геометрическое коэффициентов активности образующих его ионов: 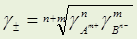
Средний коэффициент активности электролита g ± зависит от природы растворителя и вещества, концентрации, Т
В разбавленных растворах (С<0,1) g i зависит от концентрации и заряда ионов.
Правило ионной силы:
ионы с одинаковой абсолютной величиной заряда в разбавленных растворах сильных электролитов с одинаковой ионной силой имеют равные коэффициенты активности.
Ионная сила раствора I -количественная характеристика межионного взаимодействия: I = 0,5× å (сi ××z2i)
где ci – концентрация i -иона
zi - заряд i -иона
Коэффициенты активности отдельных ионовg i определяют приближенно:
1. По правилу ионной силы, используя справочник для 0,001< I < 0,1
(g I = f(I) - справочная величина)
| Ионы | Коэффициент активности для ионной силы | |||||
| 0,001 | 0,01 | 0,02 | 0,05 | 0,07 | 0,1 | |
| Водорода Однозарядные Двухзарядные Трёхзарядные | 0,98 0,98 0,77 0,73 | 0,92 0,92 0,58 0,47 | 0.90 0,89 0,50 0,37 | 0,88 0,85 0,50 0,37 | 0,86 0,83 0,36 0,25 | 0,84 0,80 0,30 0,21 |
2. По формулам Дебая-Гюккеля для водных растворов:
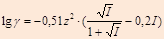 (для I» 10)
(для I» 10) 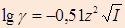 (для I £ 0,01)
(для I £ 0,01)
 Коэффициенты активности отдельных ионов g i:
Коэффициенты активности отдельных ионов g i:
ü в области высококонцентрированных растворов g i =1 и больше.
ü в области очень разбавленных растворов g i → 1
ü в области разбавленных растворов (ниже 0,1 моль/л) g зависят от концентрации и заряда ионов и мало зависят от природы растворенных веществ.
 2015-05-26
2015-05-26 807
807