Допустим, что мы располагаем раствором ацетатного буфера. Источником протонов в системе является кислота Нас
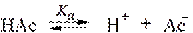
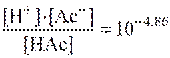
Учитывая тот факт, что кислота НАс диссоциирует очень слабо, а соль NaAc как сильный электролит диссоциирует практически полностью, можно допустить, что концентрация ионов Ас– равна концентрации NaAc. Тогда выражение Ка приобретает вид:
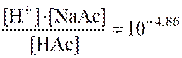
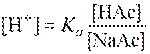
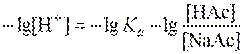
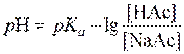
Если [НАс] = [NaAc], то 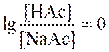 а рН = рКа = 4,86.
а рН = рКа = 4,86.
Рассуждая аналогично при вычислении рН буферных смесей, состоящих из слабых оснований и их солей, получим:
p OH = pKв – 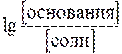
При равенстве концентраций компонентов:
р ОН = рКв; рН= 14 – рОН.
6.Гидро́лиз (от греч. hydro — вода и lysis — разложение) — взаимодействие веществ с водой с образованием различных соединений (кислот, оснований и др.). Гидролизу подвергаются соединения различных классов: соли, углеводы, белки, сложные эфиры, жиры и др.
Гидролиз солейПравить
Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH
CO32- + H2O = HCO3- + OН-
(раствор имеет щелочную реакцию, реакция протекает обратимо) 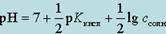
2. Гидролиз соли сильной кислоты и слабого основания:
СuСl2 + Н2О = CuClOH + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую реакцию, реакция протекает обратимо)
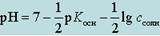
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OН)3 + 3H2S
2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3 + ЗН2S
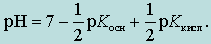
(Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
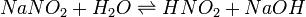
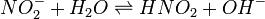
Уравнение константы равновесия для данной реакции имеет вид:
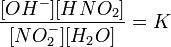 или
или 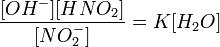
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 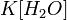
можно заменить одной новой — константой гидролиза:
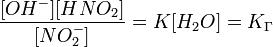
Численное значение константы гидролиза получим, используя ионное произведение воды и константу диссоциации азотистой кислоты:
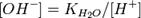
подставим в уравнение константы гидролиза равна:
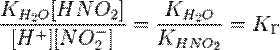
В общем случае для соли, образованной слабой кислотой и сильным основанием:
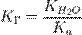
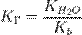
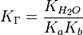
 2015-05-26
2015-05-26 1075
1075