Данные по энтропии сольватации, по умень-шению диэлектрической проницаемости и объе-ма растворителя в присутствии ионов, по снижении времени релаксации, а также по подвижности ионов в электрическом поле указывают на то, что часть молекул растворителя довольно прочно связана с ионами. Это пред-положение находит прямое подтверждение различных структурных исследованиях раство-ров. Предельное значение числа сольватации определяется координационным числом (КЧ)
Таблица 2.11. Экспериментальные данные по числам гидратации 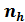 катионов
катионов 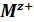
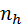 | z = 1 | z = 2 | z = 3 |
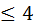 | Li | Be | – |
| 4…6 | Na | Ca | – |
| – | Mn, Fe, Co, Ni, Cu, Zn, Cd, Hg | Al, Ga, In, Tl, Bi, Ti, V, Cr, Mn, Fe, Co, Rh, Ir | |
| 8…9 | – | – | La, Ce, Pr, Sm, Eu, Gd, Tb, Dy, Lu |
сольватируемого иона (т. е. числом кратчайших эквивалентных связей, образуемых с молекулами растворителя без стерических затруднений). Подавляющее большинство катионов образует октаэдрические комплексы (КЧ = 6), для катио-нов КЧ = 4 (тетраэдрическое окружение), ионы сложного строения (лантаниды и актиниды) характеризуются КЧ до 12. В целом это соот-ветствует экспериментальным данным по числам
гидратации 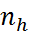 (табл
(табл  2.11). Детальную информа- цию о КЧ предоставляют дифрактометрические методы. В отношении этой величины выводы, полученные в опытах с твердыми кристалло-сольватами – моделями растворов, вполне наде-жны (по крайней мере, для концентрированных растворов). Имеются примеры экзотических сис-тем, для которых экспериментально определя-емые числа сольватации ЧС оказываются выше КЧ, что соответствует существенным взаимодей-ствиям иона с молекулами второй координаци-онной сферы.
2.11). Детальную информа- цию о КЧ предоставляют дифрактометрические методы. В отношении этой величины выводы, полученные в опытах с твердыми кристалло-сольватами – моделями растворов, вполне наде-жны (по крайней мере, для концентрированных растворов). Имеются примеры экзотических сис-тем, для которых экспериментально определя-емые числа сольватации ЧС оказываются выше КЧ, что соответствует существенным взаимодей-ствиям иона с молекулами второй координаци-онной сферы.
ЧС не только не всегда совпадают с КЧ, но и могут различаться по данным разных методов, в разной степени чувствительных к отдельным подсистемам раствора и видам взаимодействий. Кроме того, наблюдается эффективное снижение ЧС с ростом концентрации, найденное дифракто-метрически (снижение 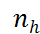 при увеличении концен-трации зафиксировано, в частности, для ионов лития, соли которого обладают высокой растворимостью). Наконец, при интерпретации экспериментальных ЧС необходимо учитывать характерные времена применяемого метода. Именно динамические свойства сольватных оболочек ответственны за получаемые в эксперименте дробные и отлича-ющиеся от КЧ значения ЧС, что и послужило основой динамической теории сольватации, раз-витой О.Я. Самойловым. Хаотическое движение всех частиц в растворе осуществляется за счет периодических перескоков этих частиц на расс-тояния порядка размеров молекул. Пусть
при увеличении концен-трации зафиксировано, в частности, для ионов лития, соли которого обладают высокой растворимостью). Наконец, при интерпретации экспериментальных ЧС необходимо учитывать характерные времена применяемого метода. Именно динамические свойства сольватных оболочек ответственны за получаемые в эксперименте дробные и отлича-ющиеся от КЧ значения ЧС, что и послужило основой динамической теории сольватации, раз-витой О.Я. Самойловым. Хаотическое движение всех частиц в растворе осуществляется за счет периодических перескоков этих частиц на расс-тояния порядка размеров молекул. Пусть 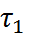 – среднее время, в течение которого ион находится в неподвижном состоянии, а
– среднее время, в течение которого ион находится в неподвижном состоянии, а 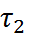 – время, необхо-димое для того, чтобы диполь растворителя, находящийся вблизи иона, порвал связь с другими диполями, изменил свою ориентацию и вошел в состав сольватной оболочки иона. Если
– время, необхо-димое для того, чтобы диполь растворителя, находящийся вблизи иона, порвал связь с другими диполями, изменил свою ориентацию и вошел в состав сольватной оболочки иона. Если 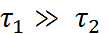 – то, молекулы растворителя успевают порвать водородную или диполь-дипольную связь с другими молекулами растворителя и войти в сольватную оболочку иона. В этих условиях ион окружает прочная сольватная оболочка (ЧС = КЧ). При обратном соотношении (
– то, молекулы растворителя успевают порвать водородную или диполь-дипольную связь с другими молекулами растворителя и войти в сольватную оболочку иона. В этих условиях ион окружает прочная сольватная оболочка (ЧС = КЧ). При обратном соотношении (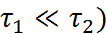 наблюдаемое ЧС близко к нулю, а при сравнимых величинах
наблюдаемое ЧС близко к нулю, а при сравнимых величинах 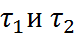 из эксперимента получаются промежуточные значения ЧС.
из эксперимента получаются промежуточные значения ЧС.
Времена релаксации молекул воды в сольватных оболочках и соответствующие харак-терные времена обмена со средой могут отли-чаться для разных ионов на порядки. Так, в водных растворах молекулы, прочно связанные с ионами лития, осциллируют медленнее, чем свободные молекулы, тогда как в случае более крупных катионов щелочных металлов имеет место противоположная ситуация (табл. 2.12.).
Таблица 2.12. Отношения времен релаксации молекул раство-рителя в сольватных оболочках ионов и в чистом раствори-теле, по данным спектроскопии ЯМР
| Ион | Растворитель | ||||
| вода | метанол | формамид | N-метил- формамид | глицерин | |
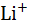 | 2,3 | 3,1 | 2,0 | – | – |
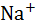 | 1,6 | 2,0 | 2,4 | 1,7 | 1,6 |
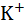 | 0,9 | 1,7 | 1,7 | 1,6 | 1,1 |
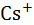 | 0,5 | 1,5 | 1,4 | 0,9 | – |
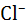 | 0,9 | 1,7 | 1,5 | 1,7 | 1,1 |
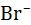 | 0,6 | 1,5 | 1,4 | 1,6 | 0,9 |
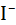 | 0,3 | 1,3 | 1,1 | 1,5 | 0,8 |
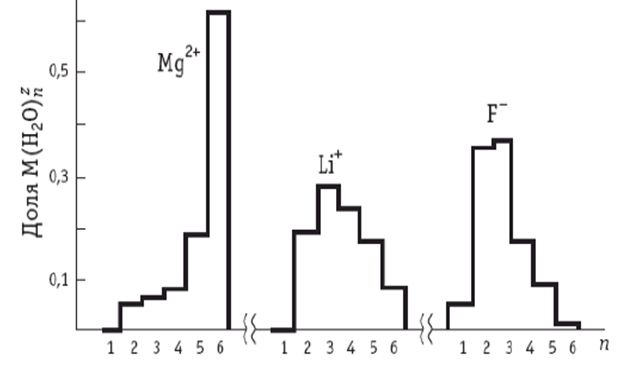
Рис. 2.9. Вероятность одновременного нахождения молекул воды в ближайшем октаэдрическом окружении М(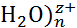 , полученная при моделировании растворов MgC
, полученная при моделировании растворов MgC 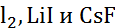 методом молекулярной динамики
методом молекулярной динамики
Наблюдаемые значения ЧС в апротонных средах обычно ниже, чем в воде из-за больших размеров молекул растворителя, более слабых ион-дипольных взаимодействий и, в то же время, зачастую более сильных ион-ионных взаимодей-ствий (образование ионных пар).
Наиболее надежно установлены строение и динамика сольватных оболочек для катионов sp- металлов, а также галогенидных и некоторых кислородсодержащих анионов в воде, ацетони-триле и метаноле. Для них, в частности, разработаны приёмы разделения откликов катионной и анионной подсистем. Значения ЧС коррелируют с эффективными размерами сольва-тированных ионов. Это иллюстрируется, напри-мер, рядами устойчивости ионных пар, образуе-мых одним и тем же анионом с разными катионами. Например, в ряду щелочных метал-лов устойчивость увеличивается от лития к цезию, что соответствует уменьшению эффекти-вного радиуса катиона в таком ряду. Следовате-льно, можно предполагать, что в достаточно быстрых процессах ион-ионной ассоциации (это работы: В.К. Семенченко 1924 г. и Н. Бьерума 1926 г.) участвуют ионы с разной степенью нена-сыщенности сольватной оболочки (она, напри-мер насыщена для лития и ненасыщена для це-зия).
На основе расчетов методом молекулярной динамики (МД), можно описать динамическую картину сольватации в терминах вероятности одновременного нахождения того или иного целого числа молекул воды в ближайшем окру-жении иона (рис. 2.9). Усредняя это распреде-ление по времени, можно получить близкие к экспериментальным (например, найденным по парциальным удельным объемам ионов из измерений сжимаемости) значения ЧС.
Принципиально важным для микроскопиче-ских моделей является выбор геометрических параметров, характеризующих ионы и их сольва-тные оболочки. Для этого обычно используют кристаллографические радиусы, рассчитанные разными способами, или проводят оценку радиу-сов гидратированных ионов из величин их эффе-ктивных объемов. Иногда руководствуются экспериментальными и расчетными расстояни-ями металл–кислород и металл–водород (табл. 2.13).
Однако для некоторых систем необходимо учитывать в расчете одновременно существо-вание всех возможных типов взаимодействий, для моделирования которых наряду с геометри-ческими требуются и другие параметры. Например, совершенно особым строением гидратных оболочек характеризуются ионы переходных металлов и f – металлов, вследствие сильных экспериментально обнаруживаемых ковалентных взаимодействий с водой, часто рассматривают как комплексные соединения. Важной особенностью сольватных оболочек анионов является наличие водородных связей с ионом-нуклеофилом и, по-видимому, также с соседними молекулами воды. Для галогенид-ионов водородные связи усиливаются в ряду от йода к фтору.
Таблица 2.13. Расстояния металл–кислород в гидратированных одно-зарядных ионах, по данным различных расчетов и экспериментов (в нм)
| Ион | Ионный Радиус (по По- лингу) | ab initio расчет | Метод Монте- Карло | Метод моле- кулярной динамики | Метод рентге- новской дифракто- метрии | Метод нейтрон- ной ди- фракто- метрии |
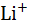 | 0,060 | 0,186 | 0,195-0,210 | 0,195-0,213 | 0,210 | 0,196 |
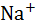 | 0,095 | 0,223 | 0,229-0,235 | 0,233-0,236 | 0,24 | – |
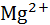 | 0,065 | 0,1905 | – | – | – | – |
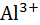 | 0,050 | 0,171 | – | – | – | – |
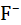 | 0,136 | – | 0,220-0,267 | 0,250-0,264 | 0,275 | – |
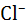 | 0,181 | – | 0,270-0,329 | 0,322-0,34 | 0,345 | 0,327 |
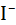 | 0,216 | – | – | 0,368 | – | – |
На рис. 2.10 показано строение ближайшего окружения лантанидных катионов в кристалло-гидратах броматных солей и концентрированных растворах. Девять молекул воды расположены в неравных позициях и связаны одновременно с анионами и катионами. Соответствующие поло-сы в ИК-спектрах оказываются чрезвычайно чув-ствительными к природе катиона и позволяют заключить, что связь катион – вода усиливается с ростом атомного номера (от Pr к Tm), при этом
 |  | ||||||
 | |||||||
 | |||||||

 Br O O Br
Br O O Br


 O O
O O



 O W O
O W O



 W W
W W



 W W
W W



M



 W
W




 O O
O O






 Br W Br W
Br W Br W
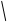


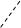




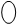
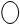




 W W W W
W W W W




 O M O Br O O Br
O M O Br O O Br



 O O
O O




 W W O O
W W O O



 W W
W W



 O O W W
O O W W
 Br
Br
Рис. 2.10. Строение ближайшего окружения гидрати-рованных лантанид-ионов М(III), определенное по данным ИК-спектроскопии для М(Br 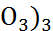 ·9
·9 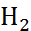 O (две проекции). Кислородные атомы молекул воды условно обозначены «W»
O (две проекции). Кислородные атомы молекул воды условно обозначены «W»
этом одновременно ослабляется взаимодействие воды с анионами. Особыми закономерностями сольватации в протонных средах (в частности, в воде) характеризуются ионы гидроксила и гид-роксония благодаря их способности образовы-вать водородные связи с растворителем, по проч-ности не уступающие связям между молекулами воды.
Исследование равновесий с участием иона водорода (протона) и молекул воды является чрезвычайно сложной экспериментальной зада-чей как из-за близкого положения спектральных откликов разных ассоциированных форм, так и в связи с аномально быстрыми релаксационными процессами в этой системе (характерные времена релаксации 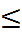 0,1 пс). На основании данных спектроскопических методов и некоторых расче-тов методом МД предполагается существование ионов
0,1 пс). На основании данных спектроскопических методов и некоторых расче-тов методом МД предполагается существование ионов 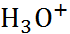 ,
, 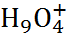 , а также ионов с малыми вре-менами жизни состава
, а также ионов с малыми вре-менами жизни состава 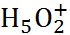 .
.
Важная информация о строении ионов в растворах может быть получена из исследований различных неравновесных явлений.
 2015-05-26
2015-05-26 1883
1883