Методы рентгеноструктурного анализа позволяют судить о строении биологических макромолекул и их комплексов (в частности, эти методы помогли установить в 1953 году структуру ДНК). В основе рентгеноструктурного анализа лежит получение кристаллов макромолекул и просвечивание их рентгеновскими лучами. По характеру дифракции рентгеновских лучей, проходящих через эти кристаллы, можно судить о строении образующих кристаллы молекул. Если кристаллы хорошего качества, то такую картину можно расшифровать с помощью специальных компьютерных программ, и это в принципе позволяет определить координаты всех атомов, из которых они построены. Поэтому РСА считают одним из наиболее мощных и информативных методов для изучения строения рибосом и других сложных белково-нуклеиновых комплексов. К недостаткам метода можно отнести, в первую очередь, трудности кристаллизации – до сих пор кристаллизация сложных рибонуклеопротеидов является скорее не наукой, а искусством, которым владеют лишь в нескольких лабораториях в мире. Даже к началу восьмидесятых годов XX века никому еще не удавалось получить пригодные для анализа кристаллы ни полных рибосом, ни их отдельных субъединиц. Вообще, кристаллизация каждого нового модельного комплекса рибосом с участниками процесса трансляции является событием.
Получить пригодные для РСА кристаллы рибосомных субчастиц даже простейших эукариот удалось впервые лишь в 2010 г. (это было сделано в группе М. Юсупова в Страсбурге). Определенные с помощью РСА координаты атомов рибосом и их модельных комплексов помещают в доступный через интернет банк данных, каждая структура имеет свой код, который известен из публикаций в научных журналах. Визуально структурную информацию можно представлять любым удобным образом. В качестве примера ниже приведена структура малой субчастицы рибосом термофильной бактерии Thermus thermophilus, полученная в 2002 г. в лаборатории В. Рамакришнана - одного из трех Нобелевских лауреатов по химии 2009 г., получивших премию за расшифровку структуры рибосомы. На этой структуре полипептидные цепи белков и полинуклеотидные цепи рРНК изображены ленточками.
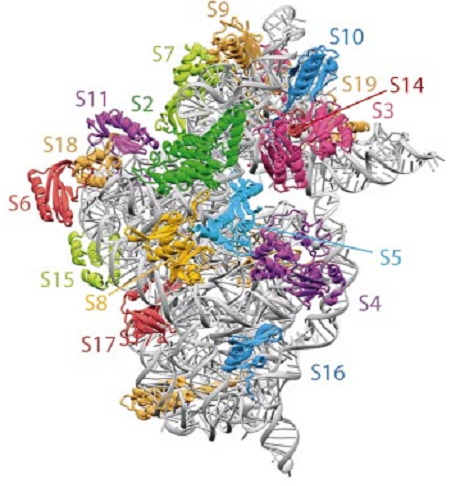 Строение малой субчастицы рибосом Thermus thermophilus по данным РСА, 2002 г.
Строение малой субчастицы рибосом Thermus thermophilus по данным РСА, 2002 г.
При всей ценности результатов, полученных с помощью РСА, следует отдавать себе отчет, что кристаллы рибосом получают в условиях, очень далеких от физиологических: при высокой концентрации солей и в присутствии специальных органических добавок (например, метилпентандиола) при пониженной температуре. Поэтому строение реально работающей рибосомы может заметно отличаться от строения рибосомы в кристалле. Наконец, РСА дает информацию только об одном, «замороженном», состоянии рибосомы, и не дает представления о конформационной динамике, необходимой для функционирования рибосомы. Поэтому полноценное представление о той структуре нуклеопротеида, которая осуществляет свои функции в клетке, можно получить только из совокупности данных, полученных с помощью РСА и различных биохимических подходов, о которых пойдет речь ниже.
 2015-05-30
2015-05-30 1886
1886








