МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, ректальные мазки, соскобы со слизистой оболочки.
• Микробиологическая диагностика эшерихиозов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, ректальные мазки, соскобы со слизистой оболочки.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование (схема 13.1.1). Является ведущим в диагностике эшерихиозов. Фекалии засевают на чашки со средой Эндо для получения изолированных колоний. Патогенные E.coli по основным биологическим свойствам (морфологии, культуральным и биохимическим признакам) не отличаются от непатогенных эшерихий — представителей нормальной микрофлоры кишечника. Для отбора подозрительных колоний применяют метод серотипирования. Материал из лак-тозоположительных колоний используют для постановки реакции агглютинации на стекле со смесью ОВ-сывороток, содержащих антитела против наиболее распространенных сероваров патогенных эшерихий (табл. 13.1.1).
Таблица 13.1.1. E.coli — возбудители эшерихиозов
| Энтеротоксиген-ные E.coli |
| Энтеропато генные E.coli |
| Энтероинвазив-ные E.col |
Энтерогеморраги-ческие E.coli
| Класс I: 055, 0111, 0119, 0125-0128, Класс И: 018, 044, 0112, |
| 0157:Н7, 0126:Н11, 0111:Н- |
| 028ас, 029, 0124, 0136, 0143, 0144, 0152, 0164, 0167 |
Об, 08, 015, 020, 025, 027, 063, 078, 080, 085, 0115, 0128ас, 0139, 0148, 0153, 0159, 0168
Обычно проверяют на агглютинабельность не менее 10 колоний с каждой чашки. При положительном результате ставят реакцию с моноспецифическими сыворотками: 026:В6, 055:В5, 0111:В4, 0124:В17 и др., после чего делают предварительное заключение. Затем пересевают несколько агтлютинабельных колоний на скошенный питательный агар для получения чистых культур. На 3-й день проверяют агглютинабельность чистых культур в реакции на стекле с ОВ-сыворотками. При положительном результате ставят развернутую реакцию агглютинации с соответствующей ОВ-сывороткой.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования: молекуляр-но-биологические исследования. Исследуемый материал,
 |
 |
полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
• Микробиологическая диагностика дизентерии
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, ректальные мазки, соскобы со слизистой оболочки.
МЕТОДЫ ДИАГНОСТИКИ:
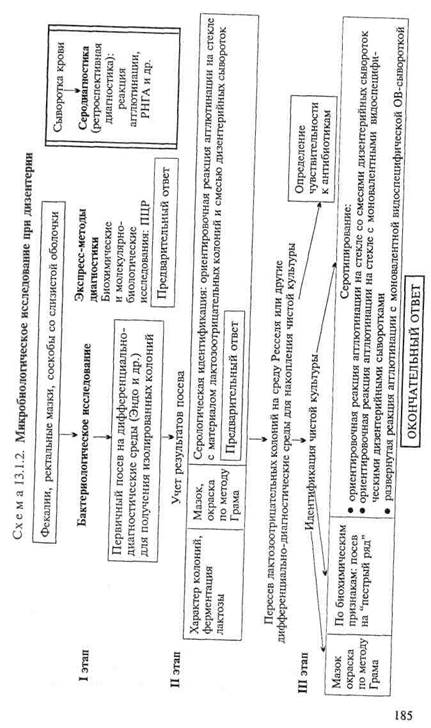
Бактериологическое исследование (схема 13.1.2). Фекалии больного засевают на дифференциально-диагностические среды (агар Эндо, Плоскирева и др.). При наличии в исследуемых испражнениях гнойных или слизисто-кровянистых комочков их выбирают петлей, промывают в изотоническом растворе хлорида натрия и наносят на поверхность питательной среды, после чего растирают шпателем. На 2-й день лактозоотрицательные (прозрачные бесцветные) колонии пересевают на среду Ресселя или на короткий "пестрый ряд" с лактозой и глюкозой.
Среда Ресселя: питательный агар, 1 % раствор лактозы, 0,1 % раствор глюкозы и индикатор бромтимоловый синий. Среду готовят таким образом, чтобы внизу она была в виде столбика, а верхняя часть имела скошенную поверхность. Исследуемую культуру засевают уколом в столбик и на поверхность среды. При ферментации углеводов происходит изменение цвета среды (желтая окраска); разрывы столбика свидетельствуют о газообразовании. Изменение цвета во всем объеме среды наблюдается при ферментации лактозы, только столбика — при ферментации глюкозы, так как содержание ее в среде в 10 раз меньше, чем лактозы. Вместо среды Ресселя можно использовать трехсахарную среду (в ее состав входят глюкоза, лактоза, сахароза, мочевина, некоторые соли и индикатор феноловый красный) или другие дифференциально-диагностические среды, позволяющие различать бактерии по способности ферментировать лактозу и глюкозу.
Оставшуюся часть колоний используют для постановки ориентировочной реакции агглютинации на стекле со смесью дизентерийных сывороток и смесью сывороток против сальмонелл (для исключения брюшного тифа или сальмонеллеза). Окончательное заключение дают на 4-й день по результатам ферментативных тестов (табл. 13.1.2) и реакции агглютинации. Выделенную чистую культуру используют для определения чувствительности возбудителя к антимикробным препаратам.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
 Таблица 13.1.2. Биохимические признаки бактерий рода Shigella
Таблица 13.1.2. Биохимические признаки бактерий рода Shigella
| Группа | Ферментация | Образование индола | Декар-бокси-лирова-ние ор-нитина | ||||
| глюкозы с газообразованием | лактозы | ман-нита | дуль-цита | ксилозы | |||
S.dysenteriae _____ в —
S.flexneri — — + — — в —
S.boydii — — + — в в —
S.sonnei — [+] + [+] в — +
Условные обозначения: (+) —положительная реакция; (^ — отрицательная реакция; [+] — поздняя реакция; в — вариабельная реакция.
Серодиагностика. Применяют для ретроспективного обоснования диагноза дизентерии при стертых и хронических формах. Ставят развернутую реакцию агглютинации по типу реакции Видаля и РИГА с эритроцитарными диагностикумами Флекс-нера и Зонне. Диагностическим титром при дизентерии, вызванной шигеллами Флекснера, считают разведение 1:200, а шигеллами Зонне — 1:100.
• Микробиологическая диагностика геликобактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: биоптат из пораженного участка слизистой оболочки желудка или двенадцатиперстной кишки.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Обнаружение возбудителя в гистологических препаратах, окрашенных по методу Романовского—Гимзы, Грама, гематоксилин-эозином и др., а также с помощью фазово-контрастной и электронной микроскопии. Helicobacter pylori — мелкие грамотрицательные изогнутые, S-образные или спиралевидные (2—3 завитка) бактерии. H.pylori имеют 4—6 жгутиков, расположенных на одном из полюсов — лофотрихи.
Бактериологическое исследование. Посев на богатые питательные среды ("шоколадный агар" и др.), содержащие гемоли-зированную кровь, сердечно-мозговой настой, дрожжевой экстракт и антимикробные препараты (ванкомицин, налидиксо-вую кислоту и амфотерицин В) для подавления роста сопутствующей микрофлоры. Инкубация посевов осуществляется при 37 °С в микроаэрофильных условиях (в атмосфере, содержащей не более 5 % 02 и 10 % С02) при повышенной влажности в течение 7 сут. Рост колоний обычно наблюдается на 3—4-е сутки. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, культуральных, биохими-
ческих признаков, чувствительности к антимикробным препаратам.
Типирование штаммов возбудителей для эпидемиологического анализа проводят методом рестрикционного анализа ДНК.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования: биохимические исследования. Выявление бактериального фермента уреазы.
♦ Определение уреазной активности в биоптате. Биоптат
помещают в бульон, содержащий мочевину и индикатор.
В положительных случаях происходит изменение цвета
индикатора в результате защелачивания среды при гид
ролизе мочевины с образованием аммиака.
♦ Дыхательный тест на уреазу. После перорального приема
мочевины, меченной радиоактивным изотопом 14С, оп
ределяют присутствие меченой двуокиси углерода 14С02
в выдыхаемом воздухе. Появление 14С02 свидетельствует
об активности уреазы (результат гидролиза меченой мо
чевины), что является косвенным признаком присутст
вия в желудке или двенадцатиперстной кишке H.pylori.
Тест используют преимущественно для предварительной
диагностики и контроля результатов лечения.
Молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителя и уреа-зе. Используют методы: ИФА, РИА и РИГА.
• Микробиологическая диагностика кампилобактериозов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, ректальные мазки, при генерализованной форме инфекции — кровь, спинномозговая жидкость. При необходимости хранения материал помещают в транспортную среду (буферный солевой раствор с добавлением нейтрального угля и метиленово-го синего или тиогликолевый бульон) при температуре 4 "С, что позволяет микробам сохранять жизнеспособность до 4 сут.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическая диагностика. Производят посев на специальные плотные среды, обогащенные аминокислотами с добавлением гемолизированной крови или нейтрального угля (для удаления токсичных метаболитов кислорода) и 3—5 антибиотиков для подавления роста сопутствующей микрофлоры (обычно используют ванкомицин, полимиксин, триметоприм,

 амфотерицин В и др.). Инкубация посевов осуществляется при 42 "С в микроаэрофильных условиях — в атмосфере, содержащей не более 5 % 02 и 10 % С02. Рост колоний наблюдается через 48—72 ч. Идентификация чистой культуры осуществляется на основании морфологии: мелкие грамотрицательные S-образно или спиралевидно (2—3 завитка) изогнутые микроорганизмы, моно- или амфитрихи; используют темнопольный и фазово-контрастный методы исследования для выявления характерной подвижности — штопорообразные движения, куль-туральных, биохимических признаков, чувствительности к антимикробным препаратам. Разработаны также биохимические (хемоидентификация) и молекулярно-биологические методы идентификации (см. главу 3).
амфотерицин В и др.). Инкубация посевов осуществляется при 42 "С в микроаэрофильных условиях — в атмосфере, содержащей не более 5 % 02 и 10 % С02. Рост колоний наблюдается через 48—72 ч. Идентификация чистой культуры осуществляется на основании морфологии: мелкие грамотрицательные S-образно или спиралевидно (2—3 завитка) изогнутые микроорганизмы, моно- или амфитрихи; используют темнопольный и фазово-контрастный методы исследования для выявления характерной подвижности — штопорообразные движения, куль-туральных, биохимических признаков, чувствительности к антимикробным препаратам. Разработаны также биохимические (хемоидентификация) и молекулярно-биологические методы идентификации (см. главу 3).
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно'поставить предварительный диагноз.
Серодиагностика. Применяют преимущественно для ретроспективной диагностики — антитела определяют в парных сыворотках в реакциях РСК, РИГА и др.
• Диагностические, профилактические и лечебные препараты
Агглютинирующие ОВ-сыворотки против патогенных кишечных палочек: ОВ-коли-сыворотка 026:В6, ОВ-коли-сыворотка 0111: В4, ОВ-коли-сыворотка 055:В5 и др. Получают путем иммунизации кроликов взвесью эшерихий соответствующего серовара и применяют в реакции агглютинации для идентификации патогенных эшерихий.
Адсорбированные агглютинирующие сыворотки для идентификации шигелл. Различают групповые и моновалентные сыворотки. Получают путем иммунизации кроликов определенными видами и сероварами S.dysenteriae, S.flexnery, S.sonnei и S.boydi с последующей адсорбцией межгрупповых и других лишних антител.
Поливалентный дизентерийный бактериофаг. Содержит фаги, лизирующие шигеллы Флекснера и Зонне. Выпускается в виде таблеток с кислотоустойчивым покрытием. Применяют для экстренной профилактики и лечения.
Дизентерийная вакцина спиртовая, сухая. Содержит шигеллы Флекснера и Зонне. Применяют для лечения хронических форм дизентерии.
Препараты эубиотиков — коли-бактерин, бифидумбактерин, бификол, лактобактерин. Применяют с лечебно-профилактическими целями (см. тему 13.2).
Антибиотики: полусинтетические пенициллины, цефалоспо-рины 2—4-го поколений, хлорамфеникол, тетрациклины, фторхинолины, сульфаниламиды, полимиксин и др.
Тема 13.2. ВОЗБУДИТЕЛИ БРЮШНОГО ТИФА, ПАРАТИФОВ И ИЕРСИНИОЗОВ. ДИСБАКТЕРИОЗ
Современная классификация бактерий рода Salmonella. Род
Salmonella включает 2 вида: S.enterica (2307 сероваров) и S.bon-gori (17 сероваров). Вид S.enterica включает 5 подвидов: enterica (I), salamae (II), arizonae (Ilia), diarisonae (Illb), houtenae (IV), indica (V), которые выделены на основании молекулярно-гене-тических признаков (гибридизационного анализа ДНК) и фе-нотипически различаются по биохимическим свойствам. Внутри подвидов сальмонеллы подразделяются на серовары по О-и Н-антигенам согласно классификации Кауфмана—Уайта. Необходимо помнить, что представители разных подвидов могут иметь общие или идентичные антигены. Абсолютное большинство сероваров (1367) относятся к подвиду enterica. Согласно ранее существовавшей классификации, сальмонеллы — представители различных сероваров — рассматривались как самостоятельные виды и имели собственные видовые названия. В настоящее время старые видовые названия используют для обозначения биоваров (сероваров), например S.enterica подвида enterica серовара typhimurium соответствует S.typhimurium, серовара typhi — S.typhi, серовара paratyphi A — S.paratyphi Л и т.д. Природным резервуаром бактерий S.enterica подвида enterica являются теплокровные животные, для остальных — холоднокровные животные и окружающая среда. Возбудители заболеваний человека относятся к подвиду enterica.
С эпидемиологической точки зрения сальмонеллы, вызывающие заболевания человека, относят к трем основным группам. Первая группа включает 3 биовара: typhi, paratyphi А и С, которые являются возбудителями строгих антропонозов (инфицируют только человека и передаются от человека к человеку прямо или опосредованно — через пищу, воду). Вторая группа включает серовары, которые адаптировались к определенному виду животных. Некоторые из этих сероваров патогенны для человека (dublin, gallinarum, schottmulleri и др.). К третьей группе относятся большинство сероваров, не имеющих специфических хозяев и способных инфицировать как человека, так и животных. По клинической классификации сальмонеллы подразделяют на возбудителей брюшного тифа (биовар typhi) и паратифов (биовары paratyphi А, С и schottmulleri) и возбудителей сальмонеллезов, включающих все остальные биовары сальмонелл, патогенных для человека. Большинство возбудителей сальмонеллезов относится к третьей группе по эпидемиологической классификации.

 а План
а План
▲ Программа
1. Биологические свойства возбудителей брюшного тифа, паратифов и иерсиниозов. Их патогенность, экология, особенности инфекции и эпидемиология вызываемых заболеваний. Дисбактериоз.
3. Диагностические, профилактические и лечебные препараты.
 2015-05-30
2015-05-30 1629
1629







