1. Биологические свойства возбудителей холеры, пищевых токсикоинфекций и интоксикаций. Их патоген-ность, экология, особенности инфекции и эпидемиология вызываемых заболеваний.
3. Диагностические, профилактические и лечебные препараты.
▲ Демонстрация
1. Мазки из чистых культур возбудителей пищевых интоксикаций кишечных инфекций: Staphylococcus aureus, Clostridium perfringens, Vibrio cholerae. Окраска по методу Грама.
2. Диагностические и лечебно-профилактические препараты.
▲ Задание студентам
1. Микроскопировать и зарисовать мазки из чистых культур возбудителей кишечных инфекций.
2. Бактериологическая диагностика холеры.
2.1. Указать материал для исследования.
2.2. Идентификация чистой культуры вибрионов, выделенных от больного:
1) изучить морфологические и тинкториальные свойства: микроскопировать мазок из чистой культуры, выделенной от больного;
2) изучить антигенные свойства: отметить результаты развернутой реакции агглютинации с диагностической 01-сывороткой;
3) изучить биохимические свойства: отметить результат гексаминового теста;
4) определить чувствительность выделенной культуры к диагностическим бактериофагам;
5) отметить способность к росту на среде с поли-миксином;
6) дать заключение.
3. Диагностика ботулизма:
1) указать материал для исследования;
2) проанализировать результаты РИГА для обнаружения ботулотоксина в сыворотке крови больного (реакция Бойдена). Дать заключение.
4. Ознакомиться с диагностическими и лечебно-профи
лактическими препаратами.
■ МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ПИЩЕВЫХ ТОКСИКОИНФЕКЦИЙ БАКТЕРИАЛЬНОЙ ПРИРОДЫ
• Микробиологическая диагностика пищевых токсикоинфекций, вызванных Escherichia spp., Salmonella spp., Proteus spp.
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, рвотные массы, промывные воды желудка больного, остатки пищевых продуктов — возможные источники и факторы передачи инфекции.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Производят путем посева
 материала на дифференциально-диагностические и элективные среды (Эндо, висмут-сульфит агар и др.) для выделения чистой культуры сальмонелл и эшерихий, а также в конденсационную воду в пробирке со скошенным питательным агаром для выявления бактерий рода Proteus. После инкубации посевов при 37 °С в течение 20—24 ч отмечают цвет колоний на чашках с дифференциальной средой и наличие "ползучего" роста, характерного для Proteus spp., в пробирке со скошенным питательным агаром. Подозрительные колонии пересевают на скошенный питательный агар для получения чистых культур и одновременно ставят с ними ориентировочную реакцию агглютинации на стекле, используя смеси диагностических сывороток. На следующий день с чистой культурой ставят развернутую реакцию агглютинации с соответствующей монорецеп-торной сывороткой и делают посев на среды "пестрого" ряда. При выделении одного и того же серовара сальмонелл или эшерихий из организма больных людей и пищевого продукта делают окончательное заключение об этиологии пищевой ток-сикоинфекции — источнике заболевания. При наличии "ползучего" роста на скошенном питательном агаре из конденсационной воды петлей берут материал для приготовления препарата "висячая" капля с целью установления подвижности и для мазка, который окрашивают по методу Грама и микроско-пируют. Затем выделяют чистую культуру, определяют биохимические и другие признаки и устанавливают вид: P.vulgaris, P.mirabilis, P.morganii и P.rettgeri.
материала на дифференциально-диагностические и элективные среды (Эндо, висмут-сульфит агар и др.) для выделения чистой культуры сальмонелл и эшерихий, а также в конденсационную воду в пробирке со скошенным питательным агаром для выявления бактерий рода Proteus. После инкубации посевов при 37 °С в течение 20—24 ч отмечают цвет колоний на чашках с дифференциальной средой и наличие "ползучего" роста, характерного для Proteus spp., в пробирке со скошенным питательным агаром. Подозрительные колонии пересевают на скошенный питательный агар для получения чистых культур и одновременно ставят с ними ориентировочную реакцию агглютинации на стекле, используя смеси диагностических сывороток. На следующий день с чистой культурой ставят развернутую реакцию агглютинации с соответствующей монорецеп-торной сывороткой и делают посев на среды "пестрого" ряда. При выделении одного и того же серовара сальмонелл или эшерихий из организма больных людей и пищевого продукта делают окончательное заключение об этиологии пищевой ток-сикоинфекции — источнике заболевания. При наличии "ползучего" роста на скошенном питательном агаре из конденсационной воды петлей берут материал для приготовления препарата "висячая" капля с целью установления подвижности и для мазка, который окрашивают по методу Грама и микроско-пируют. Затем выделяют чистую культуру, определяют биохимические и другие признаки и устанавливают вид: P.vulgaris, P.mirabilis, P.morganii и P.rettgeri.
Оценка роли условно-патогенных микроорганизмов в этиологии пищевых токсикоинфекций должна быть строго аргументирована: а) бактериологическим, серологическим, эпидемиологическим и клиническим исключением сальмонеллезов, дизентерии, холеры; б) выделением идентичных штаммов условно-патогенных бактерий из рвотных масс, промывных вод желудка, испражнений, продуктов.
■ МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ПИЩЕВЫХ ИНТОКСИКАЦИЙ БАКТЕРИАЛЬНОЙ ПРИРОДЫ
• Микробиологическая диагностика стафилококковых пищевых интоксикаций
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: рвотные массы, промывные воды желудка, подозрительные пищевые продукты.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Диагностика основана на обнаружении энтеротоксина в исследуемом материале. Энтеро-токсин Staphylococcus spp. экстрагируют изотоническим раство-
ром хлорида натрия, затем определяют его присутствие и серологическую специфичность реакцией преципитации в геле с иммунными антитоксическими сыворотками А, В, С. Техника постановки реакции описана выше (см. рис. 10.1.6). Используют также латекс-агглютинацию, ИФА, РИА и др.
Бактериологическое исследование. С целью выделения чистой культуры стафилококка исследуемый материал, который может содержать жизнеспособные бактерии, засевают в чашки с ЖСА. Полученные по схеме (см. тему 12.1) чистые культуры проверяют на способность продуцировать энтеротоксины. Для эпидемиологического анализа массовых стафилококковых интоксикаций проводят фаготипирование выделенных культур с помощью набора стафилококковых фагов.
Биопроба. Для обнаружения энтеротоксина можно использовать биопробу — скормить изучаемый материал котятам-сосункам, у которых стафилококковый энтеротоксин вызывает рвоту и понос через 30—60 мин после скармливания.
• Микробиологическая диагностика пищевых интоксикаций,
вызванных C.perfringens типа А
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: подозрительные пищевые продукты (мясные, рыбные и др.), испражнения, рвотные массы, промывные воды желудка.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Поскольку энтеротоксин C.perfringens типа А выделяется в процессе спорообразования в кишечнике больного и быстро разрушается, обнаружить его в продуктах или материале от больного практически не удается. Основным методом диагностики является бактериологический. Выделение чистой культуры производят стандартным методом (см. тему 12.2). Диагностическое значение имеет обнаружение большого количества бактерий в материале от больного и подозрительном продукте.
• Микробиологическая диагностика ботулизма
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: сыворотка крови, моча, испражнения, промывные воды желудка, остатки пищи или подозреваемые продукты (колбасы, мясные, рыбные, фруктовые, овощные консервы и др.).
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Диагностика основана на обнаружении ботулотоксина в исследуемом материале. С этой целью ставят реакцию Бойдена — РНГА с эритроцитами, нагруженными моновалентными антитоксическими противобо-

 тулиническими сыворотками типов А, В, Е. В качестве контроля используют нормальную сыворотку крови. Для выявления ботулотоксина могут быть использованы также ИФА и другие чувствительные серологические реакции.
тулиническими сыворотками типов А, В, Е. В качестве контроля используют нормальную сыворотку крови. Для выявления ботулотоксина могут быть использованы также ИФА и другие чувствительные серологические реакции.
Биопроба. Для обнаружения ботулотоксина в пищевых продуктах и определения токсигенности С botulinum можно провести реакцию нейтрализации токсина на белых мышах. Для определения серотипа токсина реакцию ставят с моновалентными сыворотками типов А, В, Е. При нейтрализации токсина гемолитической антитоксической сывороткой мыши остаются живыми.
• Микробиологическая диагностика пищевых интоксикаций, вызванных бактериями рода Bacillus
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: рвотные массы, промывные воды желудка, фекалии, подозрительные пищевые продукты.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Материал засевают на кровяной агар или селективные среды с лецитином и поли-миксином. При исследовании материала, содержащего постороннюю микрофлору (фекалии), образцы предварительно обрабатывают нагреванием при 63 "С в течение 15 мин или 50 % этиловым спиртом (45—60 мин) для уничтожения вегетативных форм бактерий. Споры возбудителя при этом сохраняются. Идентификацию выделенной чистой культуры производят по морфологии, наличию и расположению спор, тинкториальным свойствам и биохимическим признакам. Для эпидемиологического анализа осуществляется серотипирование по жгутиковому антигену (существует более 40 серотипов).
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Токсины Bacillus cereus могут быть обнаружены во всех вышеназванных видах материала, включая фекалии, с помощью серологических реакций (ИФА, РИА, иммунопреципитации и др.).
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
■ МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ХОЛЕРЫ
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения больного, рвотные массы, вода, пищевые продукты; при постмор-тальной диагностике: отрезки тонкой кишки и желчный пузырь с частью печени. При необходимости хранения материал
помещают в транспортную среду (буферный солевой раствор с глицерином). Для длительного сохранения рекомендуется полоску фильтровальной бумаги, смоченную в жидких испражнениях, поместить в герметически закрытый пластиковый контейнер — для предохранения от высыхания. Таким образом возбудитель сохраняется в материале до 5 нед.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Из исследуемого материала готовят мазки, окрашивают их по методу Грама и водным фуксином. Кроме того, из нативного материала готовят препарат "висячая" капля, в котором определяют наличие подвижных вибрионов при темнопольной или фазово-контраст-ной микроскопии. Обнаружение в мазках большого количества грамотрицательных, слегка изогнутых палочек (длиной от 1,5 до 3 мкм) и активно-подвижных вибрионов в препарате "висячая" капля позволяет дать первый предварительный положительный ответ (рис. 13.3.1; на вклейке).
Бактериологическое исследование. Материал засевают в различные жидкие и плотные элективные среды, в частности во флаконы со щелочной пептонной водой (1 % с теллуритом) и на чашки со щелочным питательным агаром. Посевы на пептонной воде инкубируют при 37 "С в течение 5—6 ч, на чашках — 10—12 ч. Из голубоватой пленки, образующейся на пептонной воде, или из ее поверхностного слоя делают мазки и препараты "раздавленная" и "висячая" капля. Этот же материал используют для постановки реакции агглютинации на стекле со специфической противохолерной 01-сывороткой. Часть пептонной воды переносят в другую пробирку для постановки нитрозоиндоловой пробы. Для этого добавляют туда же несколько капель серной кислоты. В положительном случае появляется розовое окрашивание вследствие образования нитрозоиндола под влиянием холерного вибриона. Независимо от результатов исследования делают пересев на вторую пептон-ную воду. Наличие грамотрицательных вибрионов, агглютинирующихся 01-сывороткой, позволяет дать второй предварительный ответ. Независимо от полученных результатов продолжают исследование, как показано на схеме 13.3.1.
Выделение чистой культуры и ее идентификацию проводят по 5—6 однотипным колониям, выросшим на щелочном агаре. Для ускорения хода анализа ставят развернутую реакцию агглютинации с бактериальной суспензией, приготовленной из колоний. Для этого агглютинирующую 01-сыворотку разводят в пробирках до титра пептонной водой (в объеме 0,5 мл). Затем в каждую пробирку вносят 1—2 капли суспензии бактерий. Результат реакции агглютинации учитывают после 3—4-часовой инкубации при 37 "С.
Идентификацию культуры проводят на основании опреде-
 Схема 13.3.1. Микробиологическое исследование при холере
Схема 13.3.1. Микробиологическое исследование при холере
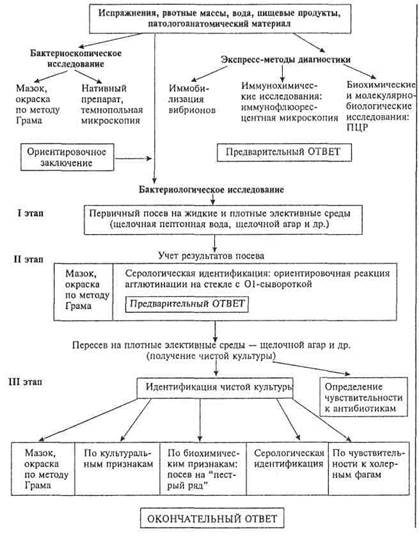
ления чувствительности вибрионов к холерному фагу, агглю-тинабельности противохолерной 01-сывороткой и типовыми агглютинирующими сыворотками Инаба и Огава, их гемолитических и биохимических свойств (оксидазная активность декарбоксилазы аминокислот, ферментация углеводов, образование ацетилметилкарбинола и др.).
Реакция Фогеса —Проскауэра: вибрионы выращивают в глюкозофосфатном бульоне, затем добавляют реактив аль-
фа-нафтол в растворе щелочи; при наличии ацетилметилкарбинола наблюдается рубиново-красное окрашивание среды.
Гексаминовый тест: культуру выращивают на бульоне с глюкозой, гексамином (уротропином) и индикатором бромти-моловым синим. В положительном случае через 6—8 ч наблюдается изменение зеленого цвета среды в желтый.
Таким образом, идентификацию культур проводят в три этапа: 1) устанавливают их принадлежность к роду Vibrio; 2) дифференцируют их от холероподобных вибрионов в реакции агглютинации с 01-сывороткой, по чувствительности к специфическому фагу и другими тестами; 3) определяют видовые признаки культур. Окончательное заключение о вьщелении и дифференцировании холерных вибрионов дают через 36—48 ч на основании комплексного изучения основных биологических признаков возбудителя (табл. 13.3.1).
Таблица 13.3.1. Тесты для дифференциации V.cholerae
| Тест | V.cholerae asiatici | V.cholerae el-tor | Неагглюти- нирующиеся вибрионы |
| + + |
Агглютинация О-сывороткой +
Агглютинация типовыми сы- +
| + + + + + + + |
воротками Огава и Инаба Лизис фагами:
| + + + + + + |
холерный фаг С (фаг IV) +
фаг Эль-Тор II —
Агглютинация куриных эрит- —
роцитов
Гемолиз эритроцитов барана —
Рост на агаре с 50 ЕД поли- —
миксина
Гексаминовый тест —
Реакция Фогеса—Проскауэра —
(образование ацетилметилкарбинола)
Трудности при оценке результатов бактериологического исследования встречаются при выделении атипичных холерных вибрионов и в первую очередь не агглютинирующихся холерной 01-сывороткой (НАГ-вибрионы). НАГ-вибрионы могут лизиро-ваться одним из специфических холерных фагов и обладать другими свойствами, сходными с холерными вибрионами.
Экспресс-методы диагностики: иммобилизация вибрионов холерными сыворотками и типовыми холерными фагами. Капли испражнений или материала с поверхности пептонной воды обрабатывают холерной 01-сыворот-
 кой, типовыми сыворотками Огава и Инаба или типовыми холерными фагами. Готовят из них препараты "раздавленная" капля, которые исследуют с помощью темнопольной и фазо-во-контрастной микроскопии. В положительном случае через 3—5 мин движение вибрионов прекращается.
кой, типовыми сыворотками Огава и Инаба или типовыми холерными фагами. Готовят из них препараты "раздавленная" капля, которые исследуют с помощью темнопольной и фазо-во-контрастной микроскопии. В положительном случае через 3—5 мин движение вибрионов прекращается.
Иммунохимические исследования. Применяют метод прямой ИФ. Мазки из исследуемого материала обрабатывают флюоресцирующей противохолерной сывороткой и исследуют в люминесцентном микроскопе. Положительным результатом считается обнаружение в препарате даже единичных вибрионов с ярким желто-зеленым свечением в виде блестящего ободка по периферии клетки. Положительный результат можно получить через 1-2 ч после начала исследования при концентрации вибрионов не менее 106 клеток в 1 мл, поэтому рекомендуется предварительное подращивание материала на питательных средах.
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Выявление антител к возбудителю является вспомогательным и применяется для ретроспективной диагностики холеры, выявления вибрионосителей и оценки напряженности постинфекционного и поствакцинального иммунитета. Для этого обычно ставят реакцию агглютинации или РИГА, диагностический титр антител в этих реакциях 1:80—1:320, а также определяют вибриоцидные антитела в реакции лизиса.
• Диагностика носительства
Во время вспышки холеры проводят массовое обследование на носительство V.cholerae.
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: ректальные мазки (фекалии, взятые тампоном из прямой кишки).
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Посев материала от 10 обследуемых на обогатительную среду с 01-агглютинирующей диагностической сывороткой. В положительных случаях через 3—4 ч начинается выпадение хлопьев в результате агглютинации размножившихся вибрионов. При обнаружении в осадке грамотрицательных подвижных вибрионов каждый из 10 пациентов обследуется индивидуально.
■ МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА КИШЕЧНЫХ ИНФЕКЦИЙ, ВЫЗВАННЫХ БАКТЕРИЯМИ РОДА VIBRIO
Возбудители: V.cholerae не 01 (серовары 04, Об и др.), V.mimicus, V.parahaemolyticus, V.fluvialis и др.
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, рвотные массы, ректальные мазки.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Изучение нативных мазков ("висячая" или "раздавленная" капля) методом темнопольной или фазово-контрастной микроскопии и фиксированных препаратов, окрашенных по методу Грама. Предварительный диагноз ставится на основании обнаружения подвижных грамотрицательных вибрионов при исключении холеры с помощью экспресс-методов (отрицательная реакция иммобилизации и иммунофлюоресценции с 01-специфической сывороткой). Метод имеет ориентировочное значение, поскольку не позволяет дифференцировать между собой различных представителей семейства Vibrionaceae.
Бактериологическое исследование. Посев материала на основные (кровяной агар), а также на элективные и дифференциально-диагностические среды для вибрионов. Возбудители дифференцируют по культуральным, антигенным и биохимическим признакам.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
■ МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА КИШЕЧНЫХ ИНФЕКЦИЙ, ВЫЗВАННЫХ БАКТЕРИЯМИ РОДА AERO-MONAS
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, рвотные массы, ректальные мазки.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. См. раздел "Микробиологическая диагностика кишечных инфекций, вызванных бактериями рода Vibrio".
Бактериологическое исследование. Посев материала на щелочную пептонную воду и селективную среду — агар с добавлением антибиотиков (ампициллина, новобиоцина и др.). При росте на кровяных средах характерен бета-гемолиз. Идентификацию чистой культуры производят на основании культураль-ных, биохимических признаков, серотипирования, фаготипи-рования, используют также молекулярно-биологические методы идентификации (риботипирование и др.).
 2015-05-30
2015-05-30 1074
1074








