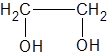
Традиционные названия этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол
Молярная масса62,068 г/моль.
Простейший представитель полиолов (многоатомных спиртов). В очищенном виде при н.у. представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов внутрь организма человека может привести к необратимым изменениям в организме и к летальному исходу. Летальная доза при однократном пероральном употреблении составляет 100—300 мл этиленгликоля (1,5-5 мл на 1 кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол. Температура плавления –12,9 °C, температура кипения +197,3 °C, хорошо растворим в воде, при этом водные растворы этиленгликоля имеют более низкую температуру замерзания, которая может варьировать от – 25°C до –60 °C в зависимости от концентрации. Хорошо растворим во многих органических растворителях. Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C.
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцом из диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Южного Чарлстона (западная Вирджиния, США) компанией "CarbideandCarbonChemicalsCo." К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начало первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике. Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при -45 °С. Коррозионноактивен, поэтому применяется с ингибиторами коррозии; в качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;в производстве целлофана, полиуретанов и ряда других полимеров, как растворитель красящих веществ, в органическом синтезе, в составах для противообледенительной обработки лобовых стёкол и самолётов, как компонент жидкости "И", используемой для предотвращения обводнения авиационных топлив, в качестве криопротектора для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море, этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля, этиленгликоль применяется такжепри производстве конденсаторов, в качестве компонента крема для обуви (1-2%), в составе для мытья стёкол вместе с изопропиловым спиртом.
В последнее время недобросовестные организаторы концертов и других театральных действий используют водно-этилспиртовую смесь этиленгликоля в машинах для дымообразования, поскольку менее токсичные смеси дорогостоящи. Происходит ультрозвуковое диспергирование данной смеси и её распыление при помощи вентилятора, в результате образуется густой туман стелящийся по поверхности сцены, этиловый спирт стабилизирует диспергированную смесь. В результате возможна легкая степень отравления при вдыхании этих паров ЭГ.
 2015-05-30
2015-05-30 954
954








