Характеристики важнейших типов аккумуляторов приведены в табл. 6.3. Рассмотрены некоторые подробности потенциал образующих реакций на аккумуляторных электродах различных типов.
Токообразующие реакции в свинцовом аккумуляторе. Согласно теории двойной сульфатации Глэдстона и Трейба, реакции, протекающие на положительном и отрицательном электродах при разряде и заряде аккумулятора, могут быть описаны следующими уравнениями:
PbO2 + 3H+ + HSO4- + 2e =PbS04 + H2O (6.25)
Pb + HSO4- = PbS04 +2e + H+ (6.26)
Суммарный процесс, протекающий при работе свинцового аккумулятора, выражается уравнением:
PbO2 + Рb + 2H2SO4 = 2РbSО4 + 2Н2О (6.27)
Анализ состава электродных масс заряженного и разряженного аккумуляторов, а также данные опытов по определению изменения концентрации серной кислоты при заряде и разряде подтверждают эту теорию. Наиболее важным доказательством ее достоверности является термодинамическое обоснование.
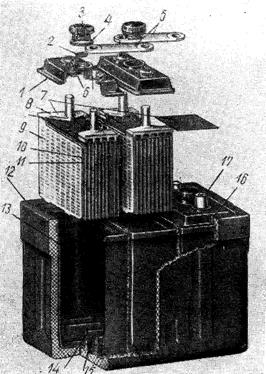
Рис. 205. Устройство и детали аккумуляторной батареи ЗСТ-70 для грузовых автомобилей: 1 — крышка из пластмассы; 2— вкладыш в пробку для задержки брызг электролита; 3 —вентиляционная пробка; 4—прокладка; 5—межэлементные соединения; б—свинцово-сурьмяные втулки в крышке; 7 —дырчатые листы из полихлорвинила для зашиты сепараторов от поломок; 8—мостик баретки; 9— отрицательная пластина; 10— сепараторы; 11 —положительная пластина; 12 — асфальто-пековый бак; 13 — кислотоупорная вставка в бак; 14 — опорные призмы; 15— шламовое пространство; 16 — герметизирующий слой заливочной мастики; 17 — конусный токоподвод (положительный полюс).
Свинцово-кислотный аккумулятор состоит из
1. Положительных пластин, выполненных из PbO2 (поверхностные, панцирные, намазные).
2. Отрицательных пластин, выполненных из губчатого свинца (коробчатые, намазные).
3. Электролит – раствор серной кислоты.
4. Бареток, связывающих в 1 полублок пластины одного знака с выводным штырем..
5. Изолирующих разделителей-сепараторов, предохраняющих от короткого замыкания.
6. Сосуда из кислотоупорного материала.
Поверхностные пластины – отливают листы толщиной 10-12 мм из чистого Pb, с большим числом прорезей (в 8-10 раз увеличивая площадь контакта с серной кислотой). Электрохимически наносят слой PbO2. По мере срабатывания наружного слоя прорабатываются более глубоколежащие слои до Pb.
В панцирных пластинах активную массу набивают в эбонитовые или пластмассовые панцири в виде трубок, скрепленных боковыми стенками в 1 пластину. В трубках прорези 0,2 мм – пропускают электролит, задерживают PbO2. Для подвода тока в центре трубок устанавливают штыри из Pb-Sb сплава.
Большинство аккумуляторов собирают из намазных пластин. Паста из PbO2 вмазывается в ячейки решеток из Pb-Sb сплава.
При погружении в H2SO4 ® PbSО4 + H2O;
Электрохимически 2PbSO4 + 2H2O + 2е = Pb + PbO2 + 2H2SO4
Одновременно формируют намазные (1-4 мм) положительные и отрицательные пластины (положительные имеют лучшие удельные характеристики, выдерживают 300-400 циклов, отрицательные служат больше).
Коробчатые отрицательные пластины имеют большую толщину (8 мм). Паста, вмазанная в ячейки с 2 сторон решетки, прикрыта с двух сторон сеткой из дырчатого свинцового листа, т.е. находится в коробке. Коробчатые отрицательные пластины в паре с поверхностными положительными работают больший срок, но имеют более низкие удельные характеристики и используются в стационарных аккумуляторах.
Таблица
Характеристики аккумуляторов
| Срок служ-бы | S, мм | L, мм | H, мм | Толщина пластин | S, дм2 | V эл-та, л | P, Кг | U, В | U зар | 10 ч режим | Старт режим | ||||
| пол | отр | I разр А | E, А×ч | I, А | E, А×ч | ||||||||||
| Для авто 3ст-126 | до 2 л | 2,6 | 2,4 | 30,6 | 4,5 | 31,8 | 6-12 | 12,6 | 34,8 | ||||||
| Стац. уста-новка С-148 | 10 л | 10,4 |
Основное требование надежность и большой срок работы. Реакции на электродах:
На отрицательных - Pb + H2SO4 = PbSO4 + 2 H+ + 2 e
PbSO4 отлагается в виде виде твердых солей, являющихся поставщиками Pb2+ при зарядах аккумулятора
На положительных – PbO2 + 2H+ + H2SO4 = PbSO4 + 2H2O – 2e
PbSO4 так же отлагается на поверхности электрода и обеспечивает поставку Pb2+ при заряде.
Суммарная реакция:
PbO2 + Pb + H2SO4 = 2PbSO4 + 2H2O (теория двойной сульфатизации)
Ео298К зависит от концентрации H2SO4
E = 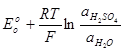 (1)
(1)
PbO2 и PbSO4 в расчет не принимают так как находятся в виде твердой соли.
Таблица
Э.д.с. свинцово-кислотного аккумулятора
| [H2SO4] | Экспериментальная | Вычисленная по DG | По (1) |
| 1,919 | 1,930 | 1,915 | |
| 2,013 | 2,025 | 2,015 | |
| 2,089 | 2,101 | 2,090 |
Пассивация PbSO4. В отрицательный электрод вводят депассиватор BaSO4, древесная мука, торф, кокс, которые адсорбируются на поверхности и обеспечивают получение мелкодисперсного осадка.
Уменьшить пассивацию положительного электрода можно увеличивая его пористость (уменьшением плотности тока, [H2SO4]).
Емкость аккумулятора зависит от температуры и плотности тока (с увеличением температуры q2 увеличивается).
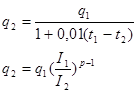
С увеличением I2, q2 уменьшается по степенной зависимости (р-1) близок к (0,4-0,5), р®(1,4-1,5).
Отрицательный электрод. При увеличении циклов поверхность губки уменьшается, снижается и емкость и, чтобы препятствовать этому, в электрод вводят расширитель (BaSO4, органика). BaSO4, увеличивает расстояние между Pb-PbSO4. Тонкие кристаллы Pb, вытянутые к PbSO4, развивают поверхность контакта. Органика, адсорбируясь на поверхности способствует измельчению зерна, что также увеличивает поверхность. Заряд вначале увеличивает Е с ростом [H2SO4], затем увеличивается поляризация. Разряд 10 часовой ведут до 1,7В. В конце практически весь ток идет на разложение Н2О.
Газовыделение и саморазряд. Pb отрицательнее Н+ и при развитой поверхности имеет место реакция:
Pb + H2SO4 = PbSO4 + H2
Увеличивается газовыделение и саморазряд аккумулятора. Sb из положительных пластин переходит в раствор, при зарядке аккумулятора осаждается на Pb губке, резко увеличивая саморазряд и газовыделение Скорость саморазряда увеличивается с увеличением температуры и [H2SO4]. Уменьшается введением тех же ПАВ, что и в отрицательном электроде. Очень вредная примесь – железо.
На положительном электроде: PbO2 + 2FeSO4 + 2H2SO4 = PbSO4 +Fe2(SO4)3 + 2H2O
Fe2(SO4)3 вызывает саморазряд и отрицательного электрода:
Fe2(SO4)3 + Pb = PbSO4 + 2 FeSO4
По ГОСТ 959-51 емкость при 20°С автомобильного аккумулятора уменьшается на 7,5% за 15 суток хранения, на 10,5% за 30 суток.
Сепараторы
Å: 1. Предохраняют от коротких замыканий.
2. Сдерживают разбухание.
3. Фиксируют расстояние между электродом
-: 1. Увеличивают внутреннее сопротивление.
2. Затрудняют доступ кислоты к пластинам.
3. Уменьшают запас серной кислоты в сосуде, занимая часть его объема.
Должны быть:
1. механически прочные эластичные
2. химически стойкие
3. иметь малое электросопротивление и меньше вытеснять H2SO4, то есть иметь большую объемную пористость.
Чаще всего выполняются из ольхового либо кедрового шпона, микропористого эбонита (мипор) или полихлорвинила (мипласт).
Электролит H2SO4.
Разряд на 1 А×ч уменьшает объем на 1 см3, при заряде объем увеличивается.
Щелочные Ni-Fe и Ni-Cd аккумуляторы
Имеют больший чем Pb-H2SO4 cрок службы, более прочные, но имеют меньшие удельные характеристики, величины Е, хуже работают при низких температурах.
Ni-Fe - с ламелевыми электродами (активная масса 12-13 мм ширина, 2,4-4 мм толщина) в плоских стальных коробочках с перфорированными стенками (отверстия мелкие). Между пластинами – эбонитовые палочки.
Ni-Fe аккумуляторы используются: в электровозы, электрокарах, погрузчиках, подводных лодках, для освещения ж/д вагонов.
Ni-Cd радиосвязь, переносные фонари, маяки. Лучше работают при низких температурах, имеют меньший саморазряд. Однако необходим дорогой и дефицитный Cd.
Герметичные Ni-Cd аккумуляторы (не требуют доливок и смены электролита, работают в любом положении, не выделяют в атмосферу газов и брызг щелочи.
Заряд прекращают при U – 1,478В, т.е раньше чем будет достигнуто напряжение разложение воды.
Доступ к электродам кислорода нужен для связывания его кадмиевой массой.
Характеристики Габарит Вес Емкость 1 ч
Накальные НКН-10 31х123х80 0,74 кг 10 А×ч 10А 0,5В
Тяговые ТЭН-500 147х556х162 30 кг 500А×ч 500А 0,5В
Å Окисно-никелевый электрод Ni(OH)2 + C – токопроводящая добавка. При катодной поляризации
Ni(OH)2 + OH- + е = NiOOН + H2O
Образование твердого раствора NiOOН в Ni(OH)2. Растворимость Ni(OH)2 очень мала. [ Ni2+] меньше 10-15г×ион/л, образуется в приэлектродном слое, нужен при зарядке.
NiOOH выполняет роль катионита – замещает Н+ на Li+, Na+, K+. При этом старение Ni(OH)2 замедляется, срок службы увеличивается. Полезные примеси Со и Ва, вредные – Fe, Si, Mg, Al.Жесткие требования к чистоте материалов.
Fe-электрод суммарно процессы на железном электроде при:
Fe- + 2OH- = Fe(OH)2 +2e
Fe + 3OH- = HFeO2- + H2O + 2 е
NaHFeO2 + H2O = NaOH + Fe(OH)2
Через образование и гидролиз HFeO-2
При заряде конкурирующий процесс – выделение водорода. Чтобы его уменьшить, надо увеличить концентрацию щелочи. Скорость саморастворения железа остается заметной (40% за месяц) – большой саморазряд и быстрая пассивация. Железо очень чувствительно к примесям. Активируют окислы Ni, As, Sb, NiS (Ni облегчает зарядный процесс, а S2- - разрядный)
Вредные примеси Mn, Al, Ca.
Cd электрод на порядок больше растворимость NaHCdO2(10-4 м/л) NaHFeO2 (10-5). Для пассивации Cd нужно больше кислорода. Лучшая работоспособность при низкой температуре. Выход по току Cd2+ больше 85%. Нет саморастворения за счет взаимодействия с NaOH с выделением водорода. Саморазряд мал из-за отсутствия взаимодействия Cd с кислородом. Полезные добавки: NiO, органика ПАВ. Вредные: Tl, Ca, Mn, Pb. Дороговизна Cd – смесь Cd и Fe 1:1. 2,7:1
Железо на 0,06В отрицательнее, но пассивируется и разряд обеих составляющих протекает одновременно. Свежезаряженый Ni-Fe 1,48 - 1,35В; Ni-Cd 1,44 - 1,35В
При высокий температуре КОН укрупняет NiOOH и уменьшает срок службы. КОН – при низких температурах; СО2 ®Na(K)2CO3 герметизируют пробки, вазелиновое масло.
Электролит: NaOH +5 г/л LiOH.
Производство щелочных аккумуляторов
1. Производство окисно-никелевой активной массы.
Подогретые до 45-50°С растворы NiSO4 (1,17 г/см3) приливают к раствору NaOH (1,30 г/см3) до остаточной концентрации NaOH 6-9 г/л. Полученную суспензию Ni(OH)2 фильтруют, отмывают от SO42- иона, сушат до содержания влаги 6,5 %, измельчают (-355 мк+65мк), смешивают с графитом (25 кг на 100 кг NiOH), с Ba(OH)2 и другими добавками. Вальцуют для улучшения контакта Ni(OH)2 c графитом. Используют для изготовления положительных электродов. Состав,%: Ni 45-48; С 18-20; Ba 0,7-1,2; Fe не более 0,65; Mg не более 0,11. Навеска 1,75г должна отдавать емкость 0,90-0,95А×ч.
2. Производство железной активной массы.
Железную руду подвергают флотационному обогащению, восстанавливают железным порошком до магнитной окиси Fe3O4 восстановление идет через стадию образования водорода:
3Fe + 4H2O = Fe3O4 + 4H2
3Fe2O3 + H2 = 2 Fe3O4 +H2O
3Fe + 3 Fe2O3 + 3H2O = 3 Fe3O4 + 3H2
Обогащенную руду смешивают с железным порошком 8-17%.вес. и спекают при 630-650°С во вращающихся печах. 10 г активной массы имеет емкость более 1,25 А×ч.
3. Производство кадмиевой активной массы
Чистую окись Cd получают путем возгонки и окисления паров металлического кадмия. Добавляют Fe3O4 для экономии кадмия. Соотношение Cd:Fe от 1:1 до 2,7:1. 100 кг кадмия + 118 кг Fe3O4 + 65 кг солярового масла (хорошо пропитывает смесь), перемешивают 2 ч. изготавливают.
Производство ламели. В стальной ленте 0,1 мм пробивают отверстие 0,35-0,18 мм в количестве, что их площадь составила 12-18% от площади ленты, после чего никелируют, пропускают профилированные валки, желобок заполняют активной массой, нагревают второй перфорированной ле7нтой загибают в замок, разрезают, скрепляют в пластины.
Уход за щелочными ламельными аккумуляторами
1. Поддержание чистоты.
2. Проведение нормальных зарядов.
3. Периодическое (через 10-12 циклов и не реже 1 раз в месяц) проведение усиленных зарядов.
Ni-Fe 12 ч током 6 часового заряда.
Ni-Cd 6 ч током 6 часового заряда и 6 ч в половину меньшим.
4. Регулярная доливка воды по мере ее расходования.
5. Смена электролита по мере его карбонизации (не реже 1 раза в год)
6. Смена электролита при изменении температурных условий эксплуатации.
7. Хранение в разряженном состоянии при 15-25°С длительно- без электролита, закрытым пробками.
В активные массы закладывается 3,8-5,1 г Ni на 1 а.ч. емкости. Это дает коэффициент использования никеля 50%.
Cd на 1 а.ч. расходуется 2,8-3,5 г, коэффициент использования 60-75%.
Железо, как наиболее дешевый материал закладывается с большим избытком.
Металлокерамические (безламелевые) пластины
Ламельные аккумуляторы имеют ограниченную поверхность контакта активной массы с электролитом, высокое внутреннее сопротивление, что препятствует их применению при высоких разрядных плотностях тока. Лучше в этих условиях работают аккумуляторы с металлокерамическими пластинами.
Из стальной ленты толщиной 0,2-0,4 мм штампом вырубают решетку необходимых размеров. Решетку никелируют. В матрицу пресс формы закладывают решетку и засыпают массу из 62% мелкодисперсного никелевого порошка и 38% карбоната аммония. Прессуют (0,8-1)т/см2, 12 ч спекают в атмосфере водорода при 850-950°С. Свеже восстановленная водородом поверхность Ni порошка обеспечивает хорошее спекание. (NH4)2CO3 разлагается при 58°С на NH3 и СО2, Н2О для обеспечения пористости 70-85%. Спеченные основы имеют толщину 1-2 мм и поступают на пропитку. Положительные пластины пропитывают горячим раствором Ni(NO3)2. Отрицательные пластины раствором CdCl2. Растворы близки к насыщенным. Пластины 1 ч подсушивают на воздухе и погружают на 2 ч в горячий раствор КОН плотностью 1,19-1,21 г/см3, затем промывают до удаления щелочи и сушат до 70-100°С. Операцию пропитки повторяют 2-3 раза до полного превращения исходных солей в Ni(OH)2 и Cd(OH)2. Заряд-разряд с никелевыми пластинами в КОН при 15-30°С проводят отдельно для положительных и отрицательных пластин. Заряд при 0,5 А/дм2 18 ч, разряд 4-6 ч. В конце разряда положительные пластины должны иметь потенциал не менее +0,28В, отрицательные - 0,52В. Их тщательно промывают и сушат.
Пластины для стабилизации Cd массы пропитывают соляровым маслом и сушат. Сухие направляют на сборку аккумулятора.
Достоинства металлокерамических пластин.
1. Высокая пористость и развитая поверхность контакта активной массы с электролитом.
2. Хороший контакт активной массы с токоподводом.
3. Положительные пластины не разбухают при работе. Это позволяет уменьшить межэлектродное расстояние. Минус – больший расход Ni: в ламельных 4-5 г/А×ч, в металлокерамических 18-24 г/А×ч (приготовление основы).
Герметичные Ni-Cd аккумуляторы
Распространены, не требуют доливок и смены электролита, работают в любом положении, при заряде не выделяют в атмосферу газов и брызг щелочи. Принцип их действия в 2 вариантах:
1. При заряде небольшая часть тока тратится на образование кислорода, к концу заряда его выделение усиливается. На Cd электроде водород начинает выделяться в конце заряда. При этом происходит заметное увеличение потенциала. Если прекратить заряд при напряжении 1,47В (когда напряжение разложения воды не достигнуто), то водород не выделяется. Небольшое количество выделившегося кислорода растворяется в электролите и восстанавливается, окисляя отрицательный электрод (кадмиевая губка окисляется кислородом легко и быстро).
Недостаток - электроды постоянно недозаряжены и постепенно теряют емкость.
2. Выгоднее второй способ реализации герметичных Ni-Cd аккумуляторов – ограничивать объем электролита (чтобы он заполнял только поры активных масс). При этом обеспечивается свободный доступ кислорода, выделившегося на положительном электроде к поверхности отрицательного электрода. Его емкость должна превышать емкость положительного электрода. Герметизируют разряженные электроды. В конце заряда, когда на положительном электроде начинает выделяться кислород, отрицательный еще недозаряжен и выделение водорода на нем не происходит.
Окисление Cd-массы кислородом приводит к тому, что отрицательный электрод всегда имеет запас недозаряженной массы и водород на нем выделяться не может, вне зависимости от продолжительности заряда и напряжения на клеммах
1 – стальной корпус, 2 – крышка, 3 – изолирующая прокладка между корпусом и крышкой, 4 - положительный электрод (Ni сетка с запрессованной окисно-никелевой активной массой контактирующий с крышкой), контактирующий с корпусом, 5 – отрицательный электрод (прессов.окиси Cd и Cu порошок), 6 – сепаратор, 7 – пружина.
Железные отрицательные электроды и смешанные (Fe-Cd) в герметичном аккумуляторе применять нельзя – не удается избежать выделения водорода и повышения давления газов из-за взаимодействия железа со щелочью с выделением водорода.
Серебряно-цинковые аккумуляторы
Находят широкое применение, несмотря на их дороговизну, поскольку их удельные характеристики в 4-6 раз превышают достигаемые у свинцово-кислотных и никель-кадмиевых аккумуляторов (табл.6.3) Они обладают стабильным напряжением при интенсивном разряде. Это объясняется тем, что при разряде активная масса положительного электрода превращается в хорошо проводящее металлическое серебро. Они имеют отдачу по энергии 85% и близкую к 100% отдачу по току. Саморазряд их незначителен. За 6 месяцев хранения они теряют не более 30% емкости.
Положительный электрод – в стальную пресс-форму укладывают каркас из серебряной проволоки, засыпают порошком AgO и прессуют на гидравлическом прессе. Иногда пресс-формы спекают в электрической печи.
Отрицательный электрод готовят прессованием смеси окси цинка с цинковым порошком. Токоподводом служит каркас из серебряной проволоки или сетки.
Электролитом служит КОН плотностью 1,4 г/см3 с растворенной до насыщения окисью цинка.
Таблица
Характеристики серебряно-цинковых аккумуляторов
| Тип аккумулятора | Габариты, мм | Вес с эл-том, г | Емкость при разрядке | Уд.емкость, Вт×ч/кг |
| СЦ-0,5 | 24х12х47 | 0,85 | ||
| СЦ-18 | 45х33х115 | |||
| СЦ-50 | 64х49х165 | |||
| СЦ-120 | 71х55х237 |
Главная проблема – обратимость цинкового электрода. Достигнуто применением пористого цинкового электрода в малом количестве электролита, насыщенном цинкатом калия.
При разряде цинкового электрода образуется цинкат калия. Поскольку электролит уже насыщен им, то в порах электрода выделяется ZnO и Zn(OH)2.
При заряде аккумулятора цинк из цинката калия выделяется на катоде, а окись цинка, реагируя с освободившейся щелочью, переходит в цинкат калия.
Токообразующие реакции в щелочных аккумуляторах с серебряным электродом (СЦА). Высокие энергетические возможности системы Ag|KOH|Zn известны уже давно. Основная трудность применения ее в аккумуляторе заключалась в создании обратимого цинкового электрода, сохраняющего свои размеры и форму при циклировании. Это было достигнуто благодаря использованию целлофанового гидратцеллюлозного сепаратора и пористого цинкового электрода при очень малом количестве электролита, насыщенного цинкатом калия.
При разряде цинкового электрода цинк переходит сначала в оксид цинка, а затем в цинкат, но так как электролит уже насыщен цинкатом калия, то в конечном счете в порах цинк выделяется в виде оксида и гидроксида:
2K2Zn(OH)4 = ZnO+ Zn(OH)2 + 4KOH + H2O (6.28)
Вторично образующийся слой оксида цинка получается рыхлым и не пассивирует электрод.
При заряде цинк из цинката калия выделяется на электроде в виде губки:
K2Zn(OH)4 + 2e + Zn + 2KOH + 2OH-, (6.29)
а освободившаяся щелочь реагирует с оксидом и гидроксидом цинка и переводит их в цинкат калия. Таким образом, концентрация цинката в электролите поддерживается постоянной до израсходования ZnO и Zn(OH)2.
Все описанные процессы совершаются, в основном, в порах электрода и не вызывают изменения размеров электродов.
Металлическое серебро на (+) электроде переходит сначала в Ag2O:
2Ag + 2OH- =Ag2O + H2O + 2e (6.30)
а затем в AgO:
Ag2O + 2OH- = 2AgO + H2O + 2e (6.31)
Соответственно на кривой 1 (рис. 6.1) имеются две площадки: первая при 1,6—1,64 В и вторая при 1,9—2,0 В. После достижения напряжения 2,1 В заряд прекращается, так как начинается интенсивное выделение кислорода, приводящее к окислению и разрушению целлофанового сепаратора. При разряде аккумулятора малыми токами на кривой 2 также обнаруживаются две площадки. В случае разряда большими плотностями тока первая площадка почти отсутствует и весь разряд протекает при одном напряжении, которое зависит от плотности тока (кривая 3).
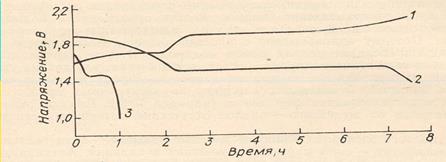
Рис. 6.1. Зависимость напряжения при заряде и разряде СЦА от времени:1- заряд; 2- разряд 8-часовым режимом; 3- разряд одночасовым режимом
Процесс, протекающий в СЦЛ, может быть представлен реакциями:
2Ag2O + 2Zn + H2O = 4Ag+ZnO + Zn(OH)2 (6.32)
2AgO+Zn + H2O = Ag2O+Zn(ОH)2 (6.33)
Стандартные потенциалы реакций:
Е°(Zn/Zn(OH)2)=-1,245В;Е°(Ag/Ag2O)=+0,344В; Е°(Ag2O/AgO) = + 0,604В
Отсюда ЭДС СЦА равна:
Е1=0,344- (-1,245) = 1,589; Е2 = 0,604- (-1,245) = 1,849 В.
На практике Е1= 1,55- 1,60 В и Е2 = 1,85- 1,89 В.
Серьезные затруднения в работе Ag-Zn аккумулятора вызывает переход в конце заряда небольшого количества окислов серебра в коллоидный раствор (10-4-10-6 г/л), которые диффундируют к Zn, где восстанавливаются до металла, образуя игольчатые дендриды, которые могут вызывать внутренние короткие замыкания. Применяют либо сепараторы из ионно-обменных смол, препятствующих диффузии серебра к цинку, либо целлофановые прокладки.
Короткие замыкания также возможны из-за разбухания цинковой губки. Для предотвращения разбухания цинковые электроды заворачивают в целлофан (набухает в 2-3 раза, хорошо проводит ток). Щель для выхода газов оставляют вверху, над электролитом. Целлофановая прослойка препятствует как диффузии Ag+ к Zn, так и разбуханию цинковой губки.
Для сохранности целлофана нужно, чтобы Uзар было меньше 2,05В. При больших начинается заметное выделение кислорода. Целлофан быстро теряет прочность, образуются разрывы, дыры. Аккумулятор выходит из строя.
Это основная причина выхода Ag-Zn аккумулятора из строя.
Разряд ведут до 1,25В при длительных режимах до 1В – при коротких (при силе тока =(3-5) кратной емкости конденсатора).
При -20°С емкость Ag-Zn аккумулятора составляет около 50% от номинальной, снижается Uразр. При низкой температуре целесообразен подогрев Ag-Zn аккумулятора.
Таблица
Выбор аккумуляторов (сравнительные характеристики)
| Свинцово-кислотные | Ni-Fe ламельные | Ni-Cd ламельные | Ni-Cd герметич. безлам | Ag-Zn | |
| Удельная емкость по весу | 0,9-1 | 0,9-1 | 4-5 | ||
| Удельная емкость по объему | 0,9-1,1 | 0,5-1,1 | 4-5 | ||
| Срок службы | 3-4 | 3-4 | 1,5-1 | 0,3-0,4 | |
| Работа при низких температурах | Хор | Не пригод. | Удовл. | Хор | Хор |
| Способность к форс разряду | хор | Не пригод | Не пригод. | Хор | Хор |
| Механическая прочность | 3-4 | 3-4 | Больше | ||
| Длительное хранение без подзарядки | 3 и > | 1-3 | 2-3 | ||
| Стоимость | 1,6-1,8 | 3,8-8 | 19-100 |
Ag-Zn применяются только там, где необходимы малый вес и объем.
Применение герметичных, но дорогих Ni-Cd оправдан, если:
1. Недопустимы выделение газов, разлив электролита (переносные радиосхемы, измерительные приборы)
2. Обслуживаются труднодоступные места, доливать воду затруднительно.
3. Необходима исключительная простота ухода – экономия в расходах на обслуживание. Требуется только подзаряд, который автоматизирован.
Ламельные применяются там, где требуется большой срок службы, разряд проводят длительными режимами.
Свинцово-кислотные обеспечивают разряд стартерными режимами при низких температурах. Аккумуляторы большей мощности, как правило, так же свинцово-цинковые.
 2015-05-22
2015-05-22 775
775








