Следующий этап, объективизирующий плодотворность наших
исследований, направленных на клиническое применение
“искусственной кости” – наукометрическая оценка библиографии периодической рецензируемой научной печати, исключающей тезисные сообщения. Данные получены по компьтерной сети “Интернет” базы данных MedLine – одного из авторитетнейших реферативных изданий в мире. Отбор библиографии осуществлялся по принципу “ближайшего окружения” относительно нашей ключевой статьи [4], также относительно нашей ключевой статьи [4], также реферированной службой MedLine.
Было получено 100 библиографических ссылок по теме нашей публикации с 1964 по 2000 год. Эти данные были разделены нами на три группы:
· публикации по исследованию строения и свойств костной ткани (1);
· публикации по исследованию свойств и применению коллаген-апатитовых имплантатов (типа «искусственной кости» или «ЛитАр») (2);
· публикации по исследованию свойств и применению любых биодеградирующих матениалов (3).
Изменения в каждой из групп оценивались по годам в процентном отношении. По полученным результатам строились графические зависимости, отражающие основные тенденции в научно-исследовательской работе в мире и имеющие обязательную рецензируемость, что сводит случайность информации к минимуму.
На графике (рис.1) представлены тенденции в развитии исследований по трём выбранным направлениям, в том числе и по формированию массива данных, связанных с развитием линии в исследовании коллаген-апатитовых
|

Рис. 1. Наукометрическая оценка тенденций в исследованиях по созданию коллаген-апатитового композита «ЛитАр» (“искусственной кости”) по данным MedLine c 1964 по 2000 год. Ряд 1 – число публикаций по исследованию костной ткани. Ряд 2 – число публикаций по коллаген-апатитовому имплантату. Ряд 3 – число публикаций по биодеградируемым имплантатам, включая и коллаген-апатитовые композиты.
композитов. Кривая ряда 1 показывает, что до конца 70-х годов основное внимание исследователей удилялось изучению свойств костной ткани. Эти данные были необходимы для создания синтетических моделей костной ткани, в том числе и биодеградируемых, таких как коллаген-апатитовые имплантаты. Кривая ряда 3 показывает, что одновременно с этим, предпринимались попытки создания имплантационных материалов, но отдельно или на коллагеновой, или апатитовой основе. Кривая ряда 2 показывает, что коллаген-апатитовых композитов до начала 80-х годов не было. Первые сообщения были сделаны в 1982 году о биологических испытаниях на животных и в 1983 году о клиническом применении в Университете города Гамбурга (Германия) [5, 6].
Необходимо отметить, что широкого отклика эти композиты не получили, т.к. представляли механическую смесь отдельно приготовленного гидроксоапатита {Ca5(OH)(PO4)3 или Ca10(OH) 2(PO4)6} и коллагена. Кроме того авторы [6] “прошивали” композит формальдегидом [7], что, несомненно, обеспечивало высокие прочностные (механические) характеристики материала, но резко увеличивало время биотрансформации композита в нативную костную ткань, понижая тем самым лечебный эффект. На графике эта ситуация отражается в виде спада научного интереса к материалам подобного рода, что видно из убыли хода кривых ряда 2 и 3 и новой волны возрастания научного интереса к исследованию нативной костной ткани.
Отсутствие в клинической практике биоадекватного универсального материала стимулировало в конце 80-х годов всплеск научного интереса по изучению кости, условий её деминерализации, консервирования и хранения. Это хорошо видно из хода кривой ряда 1.
В 1988 и 1989 году излагаются первые результаты и концепция по созданию коллаген-апатитового имплантата с заданными свойствами [8, 9]. В это время интерес к коллаген-апатитовым материалам возрастает (судя по ходу кривых ряда 2 и 3) не только у нас в стране [1, 10 – 13], но и за рубежом [14, 15].
“ЛитАр”
Анализ данных литературы показывал, что, несмотря на плодотворность идеи совместного использования коллагена и апатита, механическая смесь этих заранее полученных компонентов ожидаемой эффективности не обеспечивает. Одна из возможных причин – низкий уровень структурной интегрированности компонентов, что для механических смесей вполне нормально.
Для обеспечения высокой степени распределения компонентов между собой была исследована возможность направленной диффузии ионов
(Ca2+, OH–, PO43–), образующих гидроксофосфат кальция или гидроксоапатит непосредственно в объёме коллагена. В результате был получен материал «искусственная кость» (коммерческое название “LitAr”) с равномерным распределением солевого компонента с размерами кристаллов гидроксоапатита 5 – 10 мкм (рис. 2). Неорганическая составляющая имплантата была идентифицирована с помощью рентгено-фазового анализа по каталогу ASTM [16]. Содержание солевого компонента в композите варьировалось в пределах 75 - 85 % (вес).

Рис. 2. Электронная микроскопия коллаген-апатитового композита «ЛитАр»
(“искусственной кости”), ув.х 300. Видны волокна коллагена и кристаллики гидроксоапатита, осажденные на коллагеновых волокнах встречной диффузией ионов Ca2+, OH–, PO43 –.
Необходимо особо отметить проблему реализации высоких механических характеристик (подобно нативной кости) и одновременно высокую скорость биотрансформации материала. На качественном уровне трудно оценить возможность обеспечения этих двух важных свойств в одном имплантате.
Мы попытались оценить плодотворность идеи получения прочного (жёсткого) и быстробиодеградирующего имплантата на количественном уровне. Получение костной структуры in vitro (из основных компонентов кости: соль, белок, вода) и обеспечение необходимых значений прочности синтетического материала (имплантата) представляет значительные трудности, поэтому на практике (в условиях эксперимента) не реализуется. Тем не менее, обеспечение высокой степени структурной интегрированности биополимера (коллагена) и соли (гидроксоапатита) является одним из условий получения адекватного биодеградирующего костного материала. При этом физическо - механические свойства должны меняться в широких пределах: от вязко-текучих до твёрдых. В качестве модели, сочетающей упругие и вязкие свойства материала, а именно кости (b. - bone) и имплантата (im.- implant), можно принять модель Максвелла [17], когда результирующая деформация участка соединения кости и имплантата (b. + im.) будет определяться суммой прочностных характеристик соединяемых материалов, а прочность в оперируемом участке sор. (ор. – operate) в первые часы, равная прочности установленного имплантата sim, со временем будет складываться из прочностных характеристик имплантата и образующейся компактной (кортикальной, регенерированной; cor. – cortical, reg. – regeneration) кости sор. = sim.+ s‘cor.(reg.) (1),т.е. прочностная характеристика sор. может выражать прочность ткани в оперированном участке через сумму sim.+ s‘cor.(reg.) . Зная, что в конечной стадии регенерации scor.= const. (2). Тогда sim.+ s‘cor.(reg.) = const. (3). Продифференцировав это равенство по времени (d t), получим: d sim./ d t= - d s‘cor.(reg.)/ d t (4). Отсюда следует, что чем мягче исходный материал, тем быстрее происходит его биодеградация, и, чем выше прочностные свойства имплантата sim., тем дольше время регенерации кости в дефектном участке. Поскольку sim. << sb., то в случае сохранения каркасности вокруг резецированного дефекта целесообразно и желательно применять материал, не имеющий высоких прочностных характеристик [17, 18].
Гипотетически можно считать, что тенденция к созданию материала, имеющего высокую скорость биодеградации и большие значения предела прочности sпр. (соизмеримые с пределом прочности нативной кости
sпр. < 10kН . М-2) - неплодотворна. Это предположение подтверждается и уравнением (4): знак минус в правой части уравнения показывает, что скорость изменения предела прочности имплантата обратна увеличению предела прочности регенерата (наиболее прочного кортикального слоя, т.е. компактной части кости).
Материал изучался компьютерно-томографически для получения данных исходной плотности, относительно которых можно контролировать изменения, которые будут происходить в зоне регенерации кости при формировании полноценной нативной костной ткани. Колебания плотности рентгеновского снимка составляли 20 – 85 Н (теоретически от –5 (для коллагена) до +138 – для гидроксоапатита). Один из примеров такого сканирования материала (“искусственной кости”) приводится на рисунке 3.

Рис. 3. Компьютерно-томографи- ческий скан материала «ЛитАр» (“искусственной кости”) в интервале плотности 40 – 55 Н.
Изменения плотности в материале в интервалах 20-40, 40-55, 55-65, 70-85 Н оценивались в процентах и в целом представлены на гистограмме (рис.4).
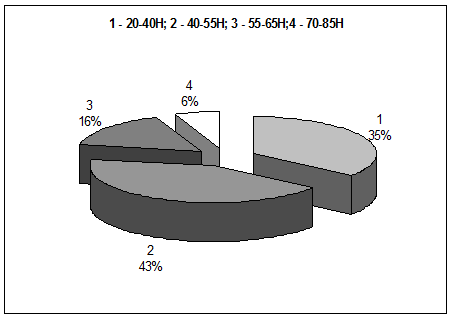 |
Рис. 4. Гистограмма распределения интервалов рентгеновской плотности
в “искусственной кости” (в процентах).
Биологические испытания на беспородных собаках показали, что в случае применения «искусственной кости» для заполнения дефекта в зоне операции (замещения) образуется тот тип костной ткани, который требует анатомическая структура в зоне регенерации кости (рис. 5) [11].


 А B
А B
 Компактный слой
Компактный слой

 Губчатое вещество
Губчатое вещество
 |
Компактный слой
 C D
C D
Рис. 5. Схема компьютерной томограммы большеберцовой кости собаки со сквозным трепанированным отверстием, заполненным «искуссвенной костью». Область ABCD была полностью замещена имплантатом (40 - 60 Н). Через 3 месяца обнаружилось образование различных типов костной
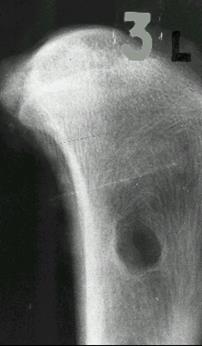 |
ткани: компактной и губчатой, как требовало анатомическое строение этого
 |
участка большеберцовой кости. Оптическая плотность в кортикальной зоне дефекта стала 330 – 640 Н.
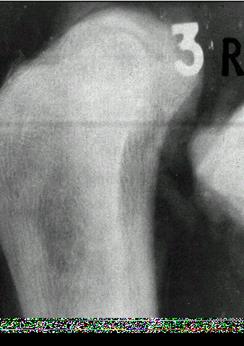
А б
Рис. 6 а, б. Увеличенные рентгеновские снимки болшеберцовой кости собаки через 5,5 месяцев после заполнения трепанированных отверстий: а – коллагеном, б – коллаген-апатитовым имплантатом.
На рис. 6 (б) наблюдается полное закрытие дефекта твердоткаными (костноткаными) структурами.
Область замещения дефекта контролировалась рентгенологически (рис. 6), компьютерно-томографически, сонографически, морфологически (в сроки от 10 дней до года). Кроме того, биопсия дефектного участка исследовалась рентгенофазовым анализом, инфракрасной спектроскопией и дифференциальным термическим анализом [10, 11].
Данные биологических испытаний по «искусственной кости» целиком положительные, что позволило начать применение такого материала в клинической практике. Возраст пациентов, у которых проводилось заполнение дефектных участков «искусственной костью» был от 16 до 50 лет.
 2015-05-23
2015-05-23 578
578








