Некрозы вызывают определённые изменения в печени; наиболее важные из них — коллапс печёночных долек, диффузное образование фиброзных септ и появление узлов регенерации. Независимо от этиологии некроза гистологическая картина при исследовании печени всегда одинаковая. Сами некрозы при аутопсии могут уже не выявляться.
После некроза гепатоцитов развивается фиброз (рис. 19-2). Так, после портального гепатита в зоне 1 появляются портопортальные фиброзные септы. Сливные некрозы в зоне 3 приводят к развитию портоцентрального фиброза. Вслед за очаговым некрозом развивается очаговый (фокальный) фиброз. В участках гибели клеток образуются узлы регенерации, которые нарушают нормальную архитектонику печени и приводят к развитию цирроза.
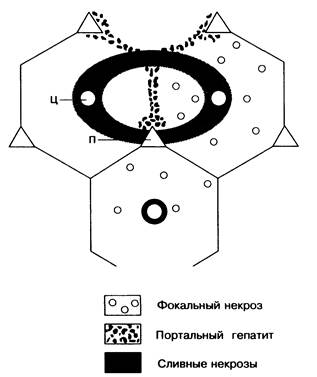
Рис. 19-2. Фокальные некрозы, портальный гепатит и сливные некрозы, приводящие к развитию портопортального и портоцентрального фиброза. Ц — центральная вена; П — портальный тракт.
По периферии узлов регенерации в области портоцентральных септ сохраняются синусоиды. Кровоснабжение из воротной вены функционирующей ткани печени, в частности центральной части узлов (зона 3), нарушается, что может способствовать прогрессированию цирроза даже после устранения его причины. В пространстве Диссе формируется патологический коллагеновый матрикс, препятствующий нормальному обмену веществ между кровью синусоидов и гепатоцитами.
Вокруг погибших гепатоцитов и пролиферирующих дуктул появляются фибробласты. Фиброз (коллагенизация) вначале ещё обратим, но после образования в зоне 1 и в дольках септ, не содержащих клеток, становится необратимым. Локализация фиброзных септ зависит от причины цирроза. Например, при гемохроматозе отложение железа вызывает фиброз портальной зоны, при алкоголизме преобладает фиброз зоны 3.
Фиброгенез [5, 20, 25]
В норме соединительнотканный матрикс печени содержит коллаген типа IV, ламинин, гепарансульфат, протеогликан и фибронектин. Все они находятся в базальной мембране. Повреждение печени влечёт за собой увеличение внеклеточного матрикса, который содержит коллаген типов I и III, образующий фибриллы, а также протеогликаны, фибронектин, гиалуроновую кислоту и другие гликоконъюгаты матрикса.
Формирование фиброзного рубца — результат превалирования процессов образования внеклеточного матрикса над его разрушением (рис. 19-3). Это сложные и многокомпонентные процессы.
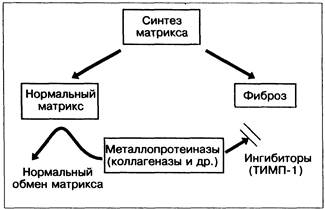
Рис. 19-3. Нормальный и патологический механизмы образования соединительной ткани. ТИМП-1 — тканевый ингибитор металлопротеиназ.
Вероятно, в будущем лучшее их понимание позволит выработать новые способы лечения. Фиброз на ранних стадиях развития — процесс обратимый; цирроз, для которого характерны сшивки между коллагеновыми волокнами и узлы регенерации, необратим.
Звёздчатая клетка печени (называемая также липоцитом, жирозапасающей клеткой, клеткой Ито, перицитом) — важнейший участник фиброгенеза. Она располагается в пространстве Диссе между эндотелиальными клетками и поверхностью гепатоцитов, обращённой к синусоиду (см. рис. 1-14, и 1-17). Аналогичные периваскулярные клетки имеются в почках и других тканях. В покое в звёздчатых клетках печени находятся капли жира, содержащие витамин А; в них сосредоточены основные запасы ретиноидов организма. Клетки экспрессируют десмин — белок, образующий филаменты, который содержится в мышечной ткани.
Повреждение печени активирует звёздчатые клетки (рис. 19-4). Они пролиферируют и увеличиваются, из них исчезают капли жира, содержащие ретиноиды, увеличивается шероховатая эндоплазматическая сеть, появляется специфический белок гладких мышц a-актин [20]. Увеличивается количество рецепторов к цитокинам, стимулирующим пролиферацию и фиброгенез. В настоящее время факторы активации звёздчатых клеток изучены слабо. Возможно, некоторое значение имеет трансформирующий фактор роста b (ТФР-b), выделяемый клетками Купффера. Кроме того, факторы активации звёздчатых клеток могут выделяться также гепатоцитами, тромбоцитами и лимфоцитами.
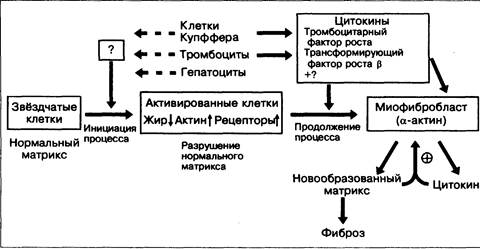
Рис. 19-4. Активация звёздчатых клеток при фиброгенезе. Миофибробласты, возможно, выделяют также ингибиторы коллагеназ, что приводит к усилению фиброгенеза.
Цитокины, воздействующие на активированные клетки, могут вызывать пролиферацию (например, тромбоцитарный фактор роста), и стимулировать фиброгенез (например, ТФР-b). На звёздчатые клетки действует также ряд других факторов роста и цитокинов, в том числе фактор роста фибробластов, интерлейкин-1 (ИЛ-1), эпидермальный фактор роста (ЭФР) и фактор некроза опухолей а (ФНО-a) [53]. Некоторые из них выделяются клетками Купффера, а также самими звёздчатыми клетками, обеспечивая аутокринную регуляцию. Кроме того, на звёздчатые клетки влияют ацетальдегид, образующийся при метаболизме алкоголя, и продукты перекисного окисления липидов, образующиеся в результате повреждающего действия алкоголя или избытка железа. Пролиферацию звёздчатых клеток стимулирует тромбин [42]. Повреждение внеклеточного матрикса звёздчатыми клетками способствует их активации.
Активированные звёздчатые клетки (миофибробласты) приобретают черты, свойственные гладкомышечным клеткам, и способны к сокращению. Они синтезируют эндотелин-1, который может вызывать их сокращение [54]. Таким образом, эти клетки могут участвовать также в регуляции кровотока.
Другой ведущий фактор образования фиброзной ткани — разрушение белков матрикса (см. рис. 19-3). Его обеспечивает ряд ферментов, называемых металлопротеиназами [5]. Выделяют 3 основные группы этих ферментов: коллагеназы, желатиназы и стромелизины. Коллагеназы разрушают интерстициальный коллаген (типов I, II и III), желатиназы — коллаген базальных мембран (типа IV) и желатин. Стромелизины способны разрушать множество других белков, в том числе протеогликаны, ламинин, желатины и фибронектин. Синтез этих ферментов происходит в основном в клетках Купффера и в активированных звёздчатых клетках. Активность металлопротеиназ подавляется тканевыми ингибиторами металлопротеиназ (ТИМП). Активированные звёздчатые клетки секретируют ТИМП-1 [31] и вследствие этого играют основную роль не только в синтезе фиброзной ткани, но и в разрушении матрикса. Установлено, что при алкогольной болезни печени на прецирротической и цирротической стадиях в крови повышается содержание ТИМП [39].
После повреждения печени большое значение приобретают ранние изменения матрикса в пространстве Диссе — отложение коллагена типов I, III и V, из которого состоят фибриллы, и фибронектина. Синусоиды превращаются в капилляры («капилляризация»), исчезают фенестры эндотелия (см. рис. 1-16), что нарушает обмен веществ между гепатоцитами и кровью. В эксперименте показано, что стенозирование синусоидов повышает сосудистое сопротивление в печени и вызывает портальную гипертензию [60]. Прогрессирование фиброза нарушает архитектонику печени и обусловливает развитие цирроза и портальной гипертензии.
 2015-06-10
2015-06-10 516
516








