РАСТВОРЫ. ОСНОВНЫЕ ПОНЯТИЯ И
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ

ВОЛГОГРАД
УДК 532.773 (076.1)
Растворы. Основные понятия и способы выражения концентрации: Методические указания / Сост. М. Ю. Романова, О.К. Жохова. Волгоград. гос. техн. ун-т.- Волгоград, 2010. – 29с.
Содержат пояснительный теоретический материал и методики проведения эксперимента к двум лабораторным работам. Даны примеры решения задач на расчеты по приготовлению растворов. Приведены варианты индивидуальных заданий для более глубокой проработки рекомендуемой литературы.
Предназначены для студентов политехнических вузов, изучающих дисциплины “Химия” и “Общая и неорганическая химия”.
Табл. 4. Библиогр.: 7 назв.
Рецензент к.х.н. Г. И. Зорина
Печатается по решению редакционно-издательского совета Волгоградского государственного технического университета.
© Волгоградский
государственный
технический
университет, 2010
1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
Растворами называют гомогенные системы, состоящие из двух и более компонентов, относительные количества которых могут изменяться в определенных пределах. Растворы принято классифицировать по агрегатным состояниям. Различают:
|
|
|
- газовые растворы (обозначаются Г-Г), которые образованы газообразными компонентами (например, воздух);
- жидкие растворы, которые можно разделить на три разновидности:
Г-Ж (раствор газообразного HCl в воде – соляная кислота), Ж-Ж (раствор этанола в воде) и Т-Ж (раствор сахара в воде);
- твердые растворы – тоже трех видов: Г-Т (раствор водорода в металлической платине), Ж-Т (амальгамы) и Т-Т (некоторые сплавы, например, раствор меди в золоте).
При описании растворов часто пользуются терминами «растворитель» и «растворенное вещество». Растворителем обычно считают тот компонент, который определяет агрегатное состояние раствора. При смешивании твердой соли и жидкой воды образуется жидкий раствор, поэтому растворителем следует считать воду, а растворенным веществом – соль. Если смешивают вещества, находящиеся в одинаковом агрегатном состоянии (например, этанол и вода), растворителем считают компонент, количество которого преобладает.
Наибольшее практическое значение имеют жидкие растворы. В этих растворах обычно протекает большинство реакций, так как в них создаются весьма благоприятные условия для перемещения молекул и тесного их сближения, необходимого для химического взаимодействия. В настоящих методических указаниях рассматриваются именно жидкие растворы.
По своей природе растворы занимают промежуточное положение между
смесями и химическими соединениями. Благодаря отсутствию у растворов
|
|
|
постоянства состава и из-за неприменимости к ним законов стехиометрии растворы приближаются к механическим смесям. С химическими соединениями их роднит однородность и довольно значительные объемные и энергетические эффекты, сопровождающие процесс растворения многих веществ.
ЯВЛЕНИЯ, СОПРОВОЖДАЮЩИЕ РАСТВОРЕНИЕ
При внесении твердого вещества в жидкость, в которой оно способно растворяться, от поверхности вещества отрываются отдельные молекулы или ионы и благодаря диффузии распределяются по всему объёму растворителя. Этот процесс мог бы продолжаться до полного растворения любого количества вещества, если бы одновременно не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы или ионы, ударяясь о поверхность ещё не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов. В начальный момент времени скорость растворения велика, а скорость кристаллизации мала. Постепенно скорости процессов выравниваются, и в системе устанавливается равновесие, при котором в единицу времени растворяется столько молекул, сколько выделяется из раствора. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным. Насыщенный раствор содержит максимально возможное (при данных условиях) количество растворённого вещества. Концентрацию насыщенного раствора некоторого вещества называют растворимостью этого вещества (обычно выражают количеством граммов вещества в 100 г растворителя).
Ненасыщенный раствор содержит вещества меньше, чем насыщенный. Поэтому при контакте ненасыщенного раствора с чистым веществом происходит его дополнительное растворение вплоть до насыщения раствора.
Можно получить и пересыщенный раствор, который содержит вещества
больше, чем насыщенный. Пересыщенный раствор неустойчив, из него легко выделяется избыток вещества до тех пор, пока не будет достигнута концентрация насыщенного раствора.
Процесс растворения всегда сопровождается выделением или поглощением энергии (теплоты растворения) и изменением объёма. Большинство кристаллических веществ растворяются в жидкостях с поглощением теплоты, однако при растворении в воде NaOH, K2CO3, безводного CuSO4 и многих других происходит выделение теплоты. Выделяется теплота и при растворении некоторых жидкостей и всех газов.
При растворении кристаллов происходит их разрушение, что требует затраты энергии. Поэтому растворение должно сопровождаться поглощением теплоты. Наличие обратного эффекта свидетельствует о взаимодействии растворителя с растворенным веществом. Это взаимодействие получило название сольватации (в частном случае водных растворов – гидратации), а продукты такого взаимодействия – сольватов (гидратов). Таким образом, растворы можно рассматривать как сложные равновесные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия.
Процесс образования гидратов протекает с выделением теплоты. При растворении твердых веществ общий тепловой эффект складывается из теплового эффекта собственно растворения и теплового эффекта гидратации. Поскольку первый из этих процессов эндотермичен, а второй экзотермичен, теплота растворения может иметь как положительное, так и отрицательное значение.
Гидраты, как правило, нестойкие соединения, часто разлагающиеся при выпаривании растворов. Но иногда гидраты настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы которых входят молекулы воды, называются
кристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат. Например, CuSO4∙5H2O, Na2SO4∙10H2O.
|
|
|
3. РАСТВОРИМОСТЬ
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора; численно она может быть выражена любым способом. Чаще всего её выражают числом единиц массы вещества в 100 единицах массы растворителя (при данной температуре).
Растворимость различных веществ в воде изменяется в широких пределах. Величина растворимости зависит от природы растворенного вещества и растворителя, а также от внешних условий.
Влияние природы компонентов раствора на растворимость довольно точно отражено в старинном правиле: «подобное растворяется в подобном». Растворимость тем выше, чем ближе друг к другу растворитель и растворяемое вещество по природе химических связей. В этом случае химические связи наиболее легко перераспределяются при образовании раствора. Поэтому вещества с ионным или полярным типом связи (например, неорганические соли) легче растворяются в полярных растворителях (например, в воде), а вещества с неполярным типом связи (иод, сера) - в неполярных или малополярных (в бензине, сероуглероде).
Влияние температуры на растворимость определяется знаком теплового эффекта растворения. Растворение большинства твердых веществ и жидкостей сопровождается поглощением теплоты. В соответствии с принципом
Ле Шателье, при увеличении температуры растворимость этих веществ увели-
чивается. Если растворение происходит с выделением теплоты, растворимость с ростом температуры понижается. Это наблюдается, например, при растворении в воде щелочей, многих солей лития, магния, алюминия. Растворение газов в воде почти всегда сопровождается выделением теплоты (вследствие сольватации их молекул), поэтому при повышении температуры растворимость газов понижается.
На растворимости твердых веществ и жидкостей давление практически не сказывается, т.к. в этом случае изменение объёма системы при растворении крайне незначительно. При растворении газообразных веществ в жидкостях объём системы уменьшается, поэтому рост давления способствует увеличению растворимости газов. Эта зависимость выражается законом Генри: при постоянной температуре растворимость газа в жидкости пропорциональна парциальному давлению газа над жидкостью.
|
|
|
4. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРЁННОГО ВЕЩЕСТВА В РАСТВОРЕ
Важнейшей характеристикой любого раствора является его концентрация. Концентрацией раствора называют количество растворенного вещества, содержащегося в определённой массе или объёме раствора или растворителя. Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой - разбавленными. Среди способов выражения концентрации наиболее часто употребляются следующие.
Массовая доля (ω) – отношение массы растворенного вещества (mв) к массе раствора: ω = mв / mр-ра, где mр-ра – масса раствора. Массовую долю часто выражают в процентах и называют процентной концентрацией. Процентная концентрация выражается числом единиц массы растворенного
вещества, содержащегося в 100 единицах массы раствора:
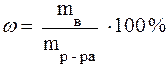 (1)
(1)
Массу раствора можно определить по формуле:
mр-ра = V·ρ, (2)
где V - объём раствора (мл, л, м3); ρ - плотность раствора (г/мл, кг/л, т/м3).
Так как раствор состоит из растворённого вещества и растворителя, то
mр-ра = mв + mр-ля . (3)
Мольная доля (N) – отношение числа молей данного вещества к общему числу молей всех веществ, содержащихся в растворе: 
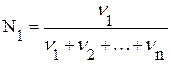 . (4)
. (4)
Если раствор состоит из двух компонентов – растворителя и растворенного
Вещества, формула (4) приобретает вид:
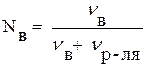 , (4а)
, (4а)
где νв – число молей растворенного вещества; νр-ля – число молей растворителя.
Сумма мольных долей всех компонентов равна 1.
Молярная концентрация (СМ) или молярность выражается числом молей растворенного вещества в 1 литре раствора.
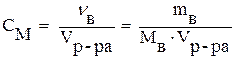
 (моль/л), (5)
(моль/л), (5)
где Мв - молярная масса вещества (г/моль); Vр-ра - объём раствора (л); νв - количество вещества (моль).
Записи 0,1 М KCl или 0,02 М CuSO4 означают соответственно децимолярный (0,1 моль/л) раствор хлорида калия и двусантимолярный (0,02 моль/л) раствор сульфата меди (II).
Эквивалентная концентрация (Сн) или нормальность (нормальная концентрация) выражается числом молей эквивалентов растворенного вещества в 1 литре раствора:
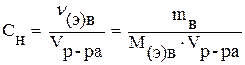 (моль/л), (6)
(моль/л), (6)
где М(э)в - эквивалентная масса вещества (г/моль); ν(э)в - количество молей эквивалентов вещества (моль).
Запись 0,2 н. HCl означает двудецинормальный (0,2 моль/л) раствор соляной кислоты.
Моляльная концентрация (Сm) или моляльность выражается числом молей растворенного вещества (νв) в 1 кг растворителя:
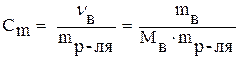 (моль/кг), (7)
(моль/кг), (7)
где mр-ля – масса растворителя, кг.
Титр (Т) – выражается числом граммов вещества в 1мл раствора:
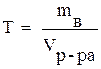 (г/мл), (8)
(г/мл), (8)
где Vр-ра - объём раствора (мл).
Использование эквивалентной концентрации растворов значительно
упрощает вычисление объёмов реагирующих друг с другом веществ. Из закона эквивалентов следует, что объёмы растворов взаимодействующих веществ обратно пропорциональны их эквивалентным концентрациям:
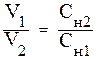 , (9)
, (9)
где V1, V2 – объёмы взаимодействующих растворов; Сн1, Сн2 – эквивалентные концентрации растворов.
Формулой (9) можно пользоваться и для расчётов по разбавлению растворов эквивалентной и молярной концентраций.
Для перехода от одного способа выражения концентрации к другому можно использовать формулы
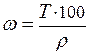 ;
; 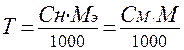 .
.
5. ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Задача 1. Сколько граммов и молей вещества содержится в 100 мл 21 % раствора NaOH (ρ = 1,23 г/мл)?
Решение. Из формулы (2) найдём массу раствора:
mр-ра = V·ρ = 100 · 1,23 = 123 г.
Из формулы (1) выразим и найдём массу вещества:
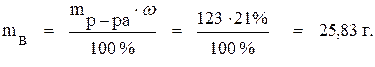
Молярная масса NaOH равна 40 г/моль. Следовательно, число молей NaOH в растворе составит:
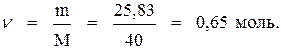
Задача 2. В 370 мл воды растворили 30 г медного купороса CuSO4· 5H2O. Найдите процентную концентрацию сульфата меди в полученном растворе.
Решение. Плотность воды равна 1 г/мл; тогда её масса
mводы = 370 · 1 = 370 г.
Таким образом, масса воды в граммах численно равна её объёму в миллилитрах.
Находим массу полученного раствора по формуле (3):
mр-ра = mв-ва + mводы = 370 + 30 = 400 г.
Определяем массу безводного сульфата меди CuSO4 в 30 г медного купороса.
Молярная масса CuSO4·5H2O равна 250 г/моль.
Молярная масса CuSO4 равна 160 г/моль.
В 250 г CuSO4· 5H2O содержится 160 г CuSO4;
В 30 г CuSO4· 5H2O содержится х г CuSO4.
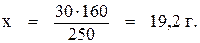
Таким образом, в растворе содержится 19,2 г безводного сульфата меди.
По формуле (1) рассчитываем процентную концентрацию раствора:
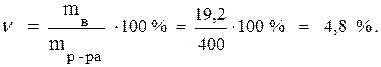
Задача 3. К 200 мл 35 % раствора NaOH (ρ = 1,38 г/мл) добавили 500 мл воды. Определите концентрацию полученного раствора.
Решение. Определим массу исходного раствора:
mр-ра = V·ρ = 200 · 1,38 = 276 г.
Найдём массу вещества в этом растворе:
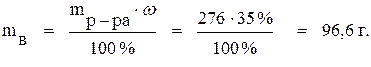
В исходном растворе содержится 96,6 г NaOH. Такое же количество будет содержаться в растворе после его разбавления. Определим массу
полученного раствора:
mр-ра = 276 + 500 = 776 г.
Зная массу раствора и содержание в нём растворённого вещества, найдём процентную концентрацию полученного раствора NaOH:
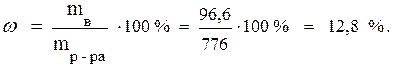
Задача 4. Сколько граммов серной кислоты содержится в 400 мл 2 М раствора? Чему равны нормальность и титр этого раствора?
Решение. Молярная масса сернойкислоты равна 98 г/моль. Переводим объём раствора в литры Vр-ра = 400 мл = 0,4 л и из формулы (5) выражаем и находим массу серной кислоты:
mв = СM · Vр-ра · M = 2 · 0,4 · 98 = 74,8 г.
Находим эквивалентную массу H2SO4 :
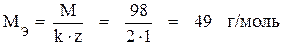 .
.
По формуле (6) определяем нормальность раствора:
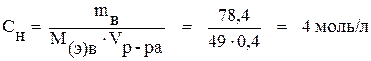 .
.
Зная молярную концентрацию раствора, нормальную можно найти и другим способом. Т.к. молярная масса больше эквивалентной в (k · z) число раз, то в соответствии с формулами (5) и (6), эквивалентная концентрация во столько же раз больше молярной:
СН = СМ · (k · z) = 2 · 2 · 1 = 4 моль/л.
Титр раствора находим по формуле (8):
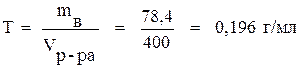 .
.
Задача 5. Вычислите эквивалентную концентрацию 49 % раствора H3PO4 (ρ = 1,33 г/мл).
Решение. Молярная масса фосфорной кислоты равна 98 г/моль. Её эквивалентная масса:
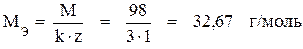 .
.
Пусть объём раствора равен 1 л (1000 мл), тогда его масса
mр-ра = V·ρ = 1000 · 1,33 = 1330 г.
Зная процентную концентрацию раствора, из формулы (1) найдём массу вещества, содержащегося в 1 л раствора:
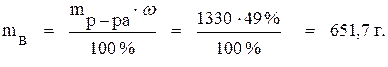
По формуле (6) определяем нормальность раствора:
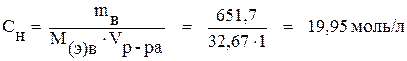 .
.
Задача 6. Сколько миллилитров 74 % раствора серной кислоты (ρ = 1,664 г/мл) потребуется для приготовления 5 л 0,25 н. раствора?
Решение. Молярная масса серной кислоты равна 98 г/моль. Её эквивалентная масса - 49 г/моль (см. задачу 4). Из формулы (6) определяем массу H2SO4, содержащуюся в 5 л 0,25 н. раствора:
mв = Cн ∙ Vр-ра ∙ Mэ = 0,25 ∙ 5 ∙ 49 = 61,25 г.
Такое же количество H2SO4 должно содержаться в исходном 74 % растворе. Из формулы (1) находим массу 74 % раствора, необходимого для приготовления 5 л 0,25 н. раствора:
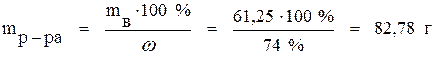 .
. 
Из формулы (2) определяем объём 74 % раствора:
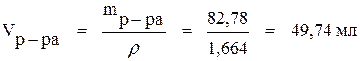 .
.
Задача 7. Сколько воды необходимо прибавить к 0,5 л 2 н. раствора NaOH, чтобы получить 0,4 н. раствор?
Решение. При разбавлении раствора его концентрация обратно пропорциональна объёму (формула (9)):
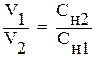
Из этой формулы находим объём 0,4 н. раствора (V2):
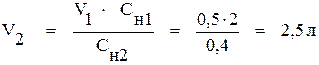 .
.
Находим количество воды, которое необходимо добавить к исходному раствору:
Vводы = V2 - V1 = 2,5 - 0,5 = 2 л.
Задача 8. Определите моляльную концентрацию и мольные доли компонентов в 20 % растворе сахара (C12H22O11).
Решение. Процентная концентрация раствора - это число единиц массы вещества, содержащихся в 100 единицах массы раствора. Следовательно, в 100 г данного раствора содержится 20 г сахара и 80 г (0,8 кг) воды. Молярная масса сахара равна 342 г/моль, молярная масса воды - 18 г/моль.
По формуле (5) находим моляльную концентрацию раствора:
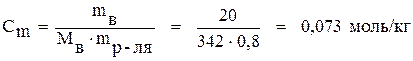 .
.
Находим число молей компонентов в 100 г раствора:
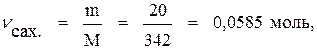
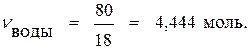
По формуле (4а) находим мольную долю сахара:
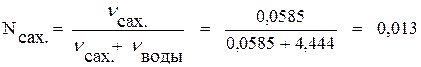 .
.
Аналогично можно найти мольную долю воды. Но сумма мольных долей всех компонентов равна 1, поэтому мольную долю воды можно найти по разности:
νводы = 1 - νсах. = 1 - 0,13 = 0,87.
Задача 9. Определите массу KOH, содержащегося в 400 мл раствора, если на нейтрализацию 24 мл этого раствора израсходовано 10 мл 0,2 н. раствора кислоты.
Решение. Так как вещества взаимодействуют в эквивалентных количествах, из формулы (9) найдём нормальную концентрацию KOH:
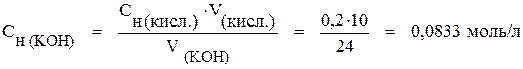 .
.
Эквивалентная масса KOH равна его молярной массе и составляет 56 г/моль. Переводим объём раствора в литры (400 мл = 0,4 л) и из формулы (6) находим массу щёлочи:
mKOH = Cн ∙ Vр-ра ∙ Mэ = 0,0833 ∙ 0,4 ∙ 56 = 1,87 г.
6. ЛАБОРАТОРНАЯ РАБОТА № 1
 2015-06-14
2015-06-14 1487
1487







