Цель работы. Научиться готовить растворы заданной концентрации из твердого вещества (кристаллогидрата) и воды.
ОПЫТ 1. Приготовление 0,5 н. раствора CuSO4 из кристаллогидрата CuSO4 · 5Н2О.
Задание: Приготовить 200 мл 0,5н. раствора CuSO4 из кристаллогидрата CuSO4 · 5Н2О.
1). Вычислите массу (mВ) безводной соли CuSO4, необходимую для приготовления 200 мл 0,5н. раствора сульфата меди
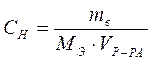 ;
;
где СН – эквивалентная концентрация раствора, моль/л;
МЭ – эквивалентная масса растворенного вещества (сульфата меди), г/моль;
VР-РА – объем раствора, л;
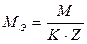 ;
;
где М – молярная масса растворенного вещества, г/моль;
К – количество катионов или анионов в сульфате меди;
Z – заряд катиона меди или аниона (сульфат-иона) по модулю;
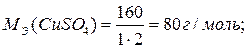
mВ = СН·VВ·МЭ = 0,5 · 0,2 · 80 = 8 г;
2). Вычислите массу кристаллогидрата CuSO4·5Н2О, необходимую для приготовления 200 мл 0,5 н раствора сульфата меди
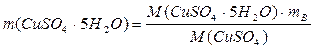 ;
;
где М(CuSO4·5Н2О) – молярная масса кристаллогидрата сульфата меди (медного купороса), г/моль;
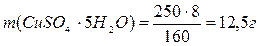
3). Взвесьте расчетное количество кристаллогидрата с помощью весов и предварительно взвешенного часового стекла.
4). Перенесите навеску через воронку в мерную колбу на 250 мл и тщательно смойте дистиллированной водой из промывалки остатки вещества с часового стекла над воронкой. Воронку также тщательно обмойте из промывалки дистиллированной водой.
5). Навеску растворите в небольшом количестве воды, затем доведите объем раствора в колбе до метки, закройте пробкой и хорошо перемешайте.
6). Определите ареометром плотность полученного раствора.
7). Рассчитайте массовую долю CuSO4 в полученном растворе, нормальную (эквивалентную) и молярную концентрации полученного раствора.
9). Рассчитайте ошибку эксперимента по формуле:
±ΔАБС = СН(теор) - СН(оп);
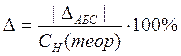 .
.
10). Результаты расчетов сведите в таблицу 3.
Таблица 3
| № | Наименование показателя | Значения |
| Объем заданного раствора, мл | ||
| Нормальность заданного раствора, моль/л | ||
| Масса CuSO4, необходимая для приготовления раствора, г | ||
| Масса CuSO4·5Н2О, необходимая для приготовления раствора, г | ||
| Плотность приготовленного раствора, г/мл | ||
| Массовая доля CuSO4 в приготовленном растворе, % | ||
| Молярная концентрация приготовленного раствора, моль/л | ||
| Нормальная (эквивалентная) концентрация приготовленного раствора, моль/л | ||
| Относительная ошибка эксперимента, % |
ОПЫТ 2. Определение массовой доли растворенного вещества в растворе эквивалентной концентрации.
Задание: Определить массовую долю CuSO4 в полученном растворе
1). Пользуясь таблицей 4, определите массовую долю полученного раствора.
Таблица 4
| Массовая доля (ω) CuSO4 , % | Плотность (ρ) раствора CuSO4 , г/мл |
| 1,009 | |
| 1,019 | |
| 1,040 | |
| 1,062 | |
| 1,084 | |
| 1,107 |
2). Если в таблице нет замеренных значений плотности, то массовая доля рассчитывается методом интерполяции (см. опыт 1, лабораторной работы № 1).
Пусть замеренная плотность раствора CuSO4 равна 1,072 г/мл. Для расчета выберем по таблице значения плотности меньше и больше замеренного и соответствующие им концентрации.
Найдите разность в значениях массовой доли и плотности:
_8% – 1,084
6% –1,062
____________________
2% – 0,022
Далее из большего значения плотности необходимо вычесть замеренное значение (1,072): 1,084 – 1,072 = 0,012
Составьте пропорцию: 2% – 0,022
х – 0,012
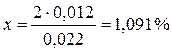
Полученное значение массовой доли (1,091%) отнимите от 8%:
8 – 1,091 = 6,909%
Это будет массовая доля CuSO4 в приготовленном растворе. Занесите рассчитанное значение в таблицу 3.
Вариант 1
1. Найдите процентную концентрацию раствора, полученного при растворении 2,5 моля NaOH в 900 мл воды.
2. Найдите молярную и эквивалентную концентрацию раствора, 3 л которого содержат 200 г карбоната калия.
Вариант 2
1. Сколько граммов HCl содержится в 100 мл 18,4 % раствора соляной кислоты (ρ = 1,090 г/мл)?
2. Определите мольные доли компонентов в растворе, полученном при растворении 6,84 г сахара (C12H22O11) в 45 мл воды. Чему равен титр этого раствора (ρ = 1,2 г/мл)?
Вариант 3
1. К 1 л 50 % HNO3 (ρ = 1,31 г/мл) прибавили 700 мл воды. Найти процентную концентрацию полученного раствора.
2. Титр раствора NaOH равен 0,08 г/мл. Найдите нормальность этого раствора.
Вариант 4
1. Содержание солей в морской воде достигает 3,5 %. Сколько соли останется после выпаривания 10 л морской воды (ρ = 1,024 г/мл)?
2. Вычислите молярную концентрацию 10 % раствора азотной кислоты (ρ = 1,056 г/мл).
Вариант 5
1. Найдите процентную концентрацию раствора сахара (C12H22O11), в котором на 1 моль сахара приходится 20 молей воды.
2. Сколько граммов серной кислоты содержится в 400 мл 0,5 н. раствора? Чему равен титр этого раствора?
Вариант 6
1. К 80 г 15% раствора добавили 20 мл воды. Найдите процентную концентрацию полученного раствора.
2. Определите молярную концентрацию 8 % раствора CuSO4 (ρ = 1,083 г/мл).
Вариант 7
1. 0,5 моля хлороводорода растворили в 72,8 мл воды. Найдите процентную концентрацию полученного раствора.
2. Какой объём воды надо добавить к 250 мл 2 М раствора карбоната натрия, чтобы получить 0,5 М раствор?
Вариант 8
1. Сколько граммов HCl содержится в 1 л 29,2% раствора соляной кислоты (ρ = 1,145 г/мл)?
2. Сколько граммов NaOH содержится в 400 мл 0,12 М раствора? Чему равен титр этого раствора?
Вариант 9
1. Сколько граммов медного купороса CuSO4 · 5H2O и воды необходимо взять для приготовления 2 л 16 % раствора сульфата меди (ρ = 1,18 г/мл)?
2. Какой объём воды надо добавить к 200 мл 1 н. раствора NaOH, чтобы получить 0,15 н. раствор?
Вариант 10
1. Сколько воды надо добавить к 300 мл 50 % раствора NaOH (ρ = 1,51 г/мл), чтобы получить 10 % раствор?
2. Найти молярную и эквивалентную концентрацию раствора, содержащего в 300 мл 12 г карбоната натрия.
Вариант 11
1. Сколько граммов H2SO4 содержится в 1 л 20 % раствора серной кислоты (ρ = 1,14 г/мл)?
2. Вычислите эквивалентную концентрацию 35 % раствора гидроксида натрия (ρ = 1,38г/мл).
Вариант 12
1. Чему равна процентная концентрация раствора, полученного при растворении 50 г вещества в 600 мл воды?
2. Какой объём 49 % раствора H3PO4 (ρ = 1,33 г/мл) требуется для приготовления 2 л 0,1 н. раствора фосфорной кислоты?
Вариант 13
1. В 1 кг воды при 25 0С растворяется 8,91 моля KI. Чему равна процентная концентрация этого раствора?
2. Сколько граммов растворённого вещества содержится в 600 мл 0,2 н. раствора сульфата меди? Чему равен титр этого раствора?
Вариант 14
1. Сколько молей серной кислоты содержится в 400 г 49 % раствора?
2. В 400 мл воды растворили 25 г хлорида натрия. Определите процентную концентрацию раствора и мольные доли компонентов.
Вариант 15
1. Сколько граммов BaCl2 · 2H2O необходимо взять для приготовления 800 г раствора, содержащего 15 % безводного хлорида бария?
2. Сколько миллилитров 0,1 н. HCl можно приготовить из 80 мл 0,75 н. раствора этой кислоты?
Вариант 16
1. Сколько молей NaCl содержится в 500 мл 20 % раствора (ρ = 1,152 г/мл)?
2. Для нейтрализации 20 мл раствора серной кислоты потребовалось 25 мл 0,05 н. раствора NaOH. Найдите нормальность и молярность кислоты.
Вариант 17
1. Сколько граммов HNO3 содержится в 10 л 50 % раствора азотной кислоты (ρ = 1,31 г/мл)?
2. Сколько миллилитров 30 % раствора сульфата магния (ρ = 1,31 г/мл) нужно взять для приготовления 5 л 0,25 М раствора?
Вариант 18
1. Сколько воды необходимо добавить к 500 мл 20 % раствора хлорида натрия (ρ = 1,152 г/мл), чтобы получить 5 % раствор?
2. В 500 мл воды растворили 75 г BaCl2. Определить моляльную концентрацию полученного раствора.
Вариант 19
1. Концентрация насыщенного при 20 0С раствора нитрата калия равна 24,1 %. Сколько граммов нитрата калия растворяется при 20 0С в 200 мл воды?
2. Определить нормальность и молярность раствора, в 400 мл которого содержится 40 г H3PO4.
Вариант 20
1. Сколько граммов хлорида калия следует добавить к 450 г 8 % раствора этой соли для получения 12 % раствора?
2. Сколько граммов растворённого вещества содержится в 320 мл 0,4 М раствора хлорида кальция. Чему равен титр этого раствора?
Вариант 21
1. К 500 мл 95,6 % H2SO4 (ρ = 1,84 г/мл), добавили 2,5 л воды. Чему равна процентная концентрация полученного раствора?
2. Сколько граммов сульфата алюминия нужно взять для приготовления 3 л 0,2 н. раствора? Чему равна молярность этого раствора?
Вариант 22
1. Сколько граммов медного купороса CuSO4 · 5H2O и воды необходимо взять для приготовления 0,5 л 16 % раствора сульфата меди (ρ = 1,18 г/мл)?
2. Какой объём 0,6 М раствора можно приготовить из 38 г сульфата магния? Чему равен титр полученного раствора?
9. СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Глинка Н. Л. Общая химия.: Уч. пособие для вузов.–изд. 32-е, исправленное - М.: Интеграл-Пресс, 2005.- 728 с.
2. Глинка Н. Л. Задачи и упражнения по общей химии: Уч. пособие для вузов–М.: Интеграл-Пресс, 2005.- 240 с.
3. Коровин Н. В. Общая химия: Учеб. Для техн. направ. и спец. вузов.-М.: Высшая школа, 1998.-559с.
4. Угай Я. А. Общая и неорганическая химия 4-е изд. - Москва: Высшая школа, 2005. - 527 с
5. Гольбрайх З. Е. Практикум по неорганической химии. - М.: Высш. шк., 1985. - 350 с.
6. Желтобрюхов В. Ф. Руководство к лабораторно-практическим занятиям по общей химии 3-е изд. под ред. Желтобрюхова В. Ф. - Волгоград: ВолгГТУ, 2005. - 116 с.
7. Строкатова С.Ф,, Андросюк Е.А., Орлова С.А. Руководство к лабораторно-практическим занятиям по общей химии. под ред. Желтобрюхова В.Ф. - Волгоград: ВолгГТУ, 2006. - 88 с.
СОДЕРЖАНИЕ
1. Общие понятия о растворах......................................... 3
2. Образование растворов. Явления, сопровождающие растворение......... 4
3. Растворимость................................................... 6
4. Способы выражения концентрации растворённого вещества в растворе.... 7
5. Примеры решения типовых задач................................... 10
6. Лабораторная работа № 1.......................................... 16
7. Лабораторная работа № 2.......................................... 20
8. Контрольные задания............................................. 23
9. Список рекомендуемой литературы................................. 27
 2015-06-14
2015-06-14 7700
7700
