Чтобы рассчитать рН сильных оснований (щелочей) и сильных кислот, следует помнить несколько основных положений:
- к щелочам относятся основания, образованные металлами семейства s - элементов, кроме Mg и Ве, к сильным кислотам - такие как HCl, HNO3, H2SO4, HI, HClO4, HBr и др.;
- диссоциация сильных электролитов - процесс необратимый:
H2SO4 Þ 2H+ + SO4 2-
то есть молекулы сильных электролитов практически полностью диссоциируют на ионы (a = 1);
- вследствие полной диссоциации сильных электролитов концентрация заряженных частиц в растворе достаточно велика, поэтому в расчетах вместо концентрации используют активность “ а ”, которая связана с концентрацией соотношением (1) (см. Введение);
- коэффициент активности ионов g i в разбавленных растворах (С < 0,1 моль/л) является функцией ионной силы раствора I, которая равна полусумме произведений концентраций всех видов ионов в растворе на квадрат их заряда
I = 1/2 å C i Z i 2 (6)
Зная величину I, можно по справочным таблицам найти коэффициенты активности ионов g i, а затем и их активность: a i = g i C i.
Пример 5. Рассчитайте рН 0,02 М раствора Н2SO4.
Решение. Запишем уравнение диссоциации серной кислоты:
H2SO4 Þ 2 H+ + SO4 2-.
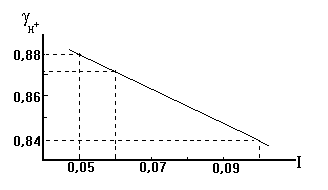
Cогласно уравнению при полном распаде на ионы концентрация ионов SO42- составит 0,02 моль/л, а концентрация ионов Н+ - в 2 раза больше, то есть 0,04 моль/л. Для расчета рН следует определить активность ионов Н+ в данном растворе: а Н+ = gH+СH+. Коэффициент активности найдем по правилу ионной силы из табл. 2.. Ионная сила раствора: I = 1/2 (0,02 . 22 + 0,04 . 1) = 0,06. В табл.2 имеются данные для gH+ при I = 0,05 и I = 0,1. Коэффициент активности для I = 0,06 найдем методом интерполяции, допуская линейную зависимость g от I в данном интервале (см. график). Итак, для I = 0,06 g = 0,872. Искомое значение рН = - lg a H+ = - lg 0,872 . 0,04 = 1,46.
Ответ: рН = 1,46.
Пример 6. Рассчитайте, как изменится рН 0,05 М раствора NaOH при введении в него 0,05 моль/л KCl.
Решение. При добавлении к раствору щелочи сильного электролита KСl молярная концентрация ионов ОН- не изменится. Однако резко возрастет ионная сила раствора, что приведет к уменьшению коэффициента активности ионов, снижению активности а OH- и, следовательно, к изменению рН.
1) Рассчитаем сначала рН раствора чистой щелочи. Согласно уравнению диссоциации NaOH Þ Na+ + OH- концентрация ионов ОН- равна 0,05 моль/л. Ионная сила данного раствора: I= 1/2 (0,05 . 12 + 0,05 . 12) = 0,05.В табл. 2 для однозарядных ионов находим коэффициент активности g = 0,85. Тогда а OH- = g OH-. СOH- = 0,85 . 0,05 = 0,043 и рОН = - lg a OH- = - lg 0,043 = 1,37. pH = 14 — 1,37 = 12,63.
2) Теперь рассчитаем рН после добавления в раствор NaOH соли KСl. Хлористый калий диссоциирует нацело: KCl Þ K+ + Cl - и дает в раствор 0,05 моль/л ионов К+ и столько же ионов Сl -. Следовательно, ионная сила такого раствора с учетом всех видов ионов станет равной:
I = 1/2 å C i Z i 2 = 1/2 (COH- . ZOH 2 + CNa+ . ZNa+ 2 + CCl- . ZCl -2 + CK+ . ZK+2) = 0,1. При такой ионной силе gOH- = 0,8 (см. табл.2), рОН = - lg 0,8 . 0,05 = 1,4. pH = 14 — 1,4 = 12,6.
Ответ: рН уменьшится с 12,63 до 12,6.
Пример 7. Рассчитайте концентрацию основания Ва(ОН)2 в растворе с рН=11,3; коэффициент активности g OH- = 0,965.
Решение. Ва(ОН)2 - щелочь, сильный электролит, диссоциирует полностью по уравнению: Ва(ОН)2 Þ Ва 2+ + 2 ОН -.
1) Определим сначала рОНраствора и активность ионов ОН -:
рОН = 14 — 11,3 = 2,7, откуда а OH- = 10-2,7 моль/л.
· 2) Из соотношения а OH- = g OH- . СOH- находим концентрацию OH- - ионов:
С OH- = 10 -2,7/ 0,965 = 0,002 моль/л.
3) Рассчитаем теперь концентрацию щелочи. Поскольку каждая молекула Ва(ОН)2 при диссоциации дает два иона ОН -, то С Ba(OH) = С OH- /2 = 0,002 /2 = 0,001 моль/л.
Таблица 2.
 2015-06-14
2015-06-14 4976
4976
