При этом предполагается отсутствие межмолекулярного взаимодействия как между частицами растворенного вещества, так и между молекулами растворителя и частицами растворенного вещества. Частицы растворителя и растворенного вещества вследствие процессов диффузии перемешиваются и равномерно распределяются по всему объему раствора.
Как выяснилось впоследствии, физическая теория удовлетворительно описывает поведение лишь идеальных растворов, в которых частицы растворителя и частицы растворенного вещества действительно практически не взаимодействуют между собой. Примерами идеальных растворов являются многие газовые растворы.
Не реагирующие между собой газы смешиваются друг с другом в неограниченных соотношениях.
Химическая теория
Химическая или сольватная теория растворов предложена Д.И. Менделеевым (1887 г.). Менделеев, посвятивший исследованиям растворов более сорока лет, первым указал, что в реальном растворе могут существовать не только частицы растворенного вещества и растворителя (примерами таких растворов являются растворы Н2, О2, N2 в воде или в жидких углеводородах), но часто может происходить химическое или физическое взаимодействие частиц растворяемого вещества с растворителем. Это легло в основу разработанной им теории растворов.
|
|
|
Суть этой теории состоит в том, что между частицами растворенного вещества и молекулами растворителя происходит взаимодействие, в результате которого образуются нестойкие соединения переменного состава называемые сольватами или гидратами, если растворителем является вода.
Главную роль в образовании сольватов играет водородная связь. Рассмотрим механизм растворения вещества на примере растворения NaCI в воде.
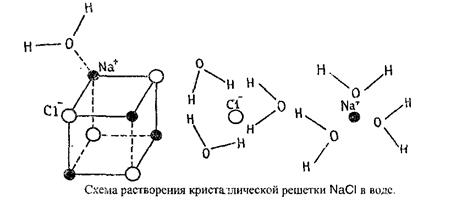
Из этого рис. видно, что положительные и отрицательные ионы, имеющиеся в кристаллической решетке, могут по законам электрического взаимодействия притягивать или отталкивать полярные молекулы растворителя. Например, положительно заряженные ионы Na+ могут быть окружены одним или несколькими слоями полярных молекул воды (гидратация ионов), отрицательно заряженные ионы Cl- также могут взаимодействовать с молекулами полярного растворителя, но ориентация диполей воды вокруг ионов Cl- будет отличаться от ориентации вокруг ионов Na+
Исследование растворов различными методами показало, что в водных растворах образуются соединения частиц растворенного вещества с молекулами воды — гидраты. В случае сульфата меди присутствие гидратов легко обнаружить по изменению цвета: безводная соль белого цвета, растворяясь в воде, образует раствор синего цвета.
Иногда гидратная вода настолько прочно связана с растворенным веществом, что при выделении его из раствора входит в состав его кристаллов.
|
|
|
Кристаллические вещества, содержащие в своем составе воду, называются кристаллогидратами, а вода, входящая в структуру таких кристаллов, называется кристаллизационной.
Таким образом, растворы занимают промежуточное положение между химическими соединениями и смесями. С одной стороны растворы, как и химические соединения, однородны. Образование растворов сопровождается, как правило, тепловым эффектом, что свидетельствует о взаимодействии растворенного вещества с молекулами растворителя. С другой стороны, в растворах нет строгого соотношения между растворенным веществом и растворителем, т.е. растворы не подчиняются закону постоянства состава, кроме того, они могут быть разделены на составные части (например, при упаривании раствора хлорида натрия можно выделить из раствора NaCI).
 2015-06-14
2015-06-14 1387
1387
