Разбавленные растворы неэлектролитов можно рассматривать как идеальные. Тогда такие свойства растворов (коллигативные свойства), как давление пара, температура кипения и температура замерзания (кристаллизация), осмотическое давление будут зависеть только от числа находящихся в растворе частиц растворённого вещества и от количества растворителя.
Так, согласно закону Рауля, величина относительного понижения давления насыщенного пара над раствором равна молярной доле растворённого вещества
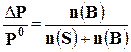 ;
; 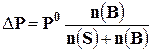 ;
; 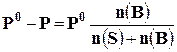 , (3)
, (3)
где Р0 – давление насыщенного пара растворителя над чистым растворителем;
Р – давление насыщенного пара растворителя над раствором; n(В) – количество растворённого вещества, моль; n(S) – количество растворителя, моль.
Преобразуя уравнение (3) относительно Р, получим
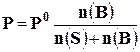 . (4)
. (4)
Пример 2. Вычислите давление насыщенного пара растворителя над раствором, содержащим 45 г глюкозы С6Н12О6 в 720 г воды при 25 °С, если давление насыщенного пара воды при этой температуре равно 3,16 кПа.
Решение. Молярная масса воды равна 18 г/моль, а глюкозы 180 г/моль. Находим количество растворенной глюкозы: n(В) = 45/180 = 0,25 моль; количество растворителя: n(S) = 720/18 = 40 моль. В уравнение (4) подставим значения Р0, n(S) и n(В) получим, что давление насыщенного пара растворителя над раствором будет Р = 3,16×40/(40 + 0,25) = 3,14 кПа.
Согласно закону Рауля растворы кипят при более высокой температуре и замерзают (кристаллизуются) при более низкой температуре, чем чистый растворитель.
Повышение температуры кипения (DТкип) раствора пропорционально моляльной концентрации раствора и выражается уравнением
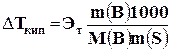 , (5)
, (5)
где DТкип – повышение температуры кипения раствора, равное разности между температурой кипения раствора Тр и температурой кипения растворителя Т0: DТкип = Тр – Т0; Эт – эбулиоскопическая постоянная растворителя, характерная для данного растворителя и не зависящая от природы растворённого вещества. Эбулиоскопическая постоянная растворителя показывает повышение температуры кипения, которое соответствует раствору, содержащему 1 моль неэлектролита на 1000 г (1кг) растворителя. Единица К×кг/моль. Численные значения Эт для некоторых растворителей приведены в табл. 4; m(В) – масса растворённого вещества, г, М(В) – молярная масса растворённого вещества, г/моль; m(S) – масса растворителя, г.
Пример 3. При какой температуре будет кипеть раствор тростникового сахара в воде с массовой долей 1%? Молярная массе сахара 342 г/моль. Эт для воды 0,512 К×кг/моль.
Решение. Раствор с массовой долей 1 % содержит 1 г сахара и 99 г воды. Подставляя в уравнение (5) цифровые значения, получим:
DТкип = 0,512×1×1000/(342×99) = 0,015 K.
Температура кипения воды (Т0) равна (273 + 100) = 373 К, DТкип = Тр – Т0. Подставляем в это уравнение значения DТкип, Т0 получим: Тр = Т0 + DТкип =
= 373 + 0,015 = 373,015 К, т.е. раствор сахара с массовой долей 1 % кипит при температуре 373,015 К (100,015 °С).
Пример 4. В 10,6 г раствора содержится 0,401 г салициловой кислоты (С7Н6О3), растворенной в этиловом спирте. Раствор кипит на 0,337 К выше, чем чистый спирт. Определите молярную массу салициловой кислоты.
Решение. Преобразуем уравнение (5) относительно молярной массы М(В) растворённого вещества
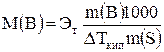 . (5а)
. (5а)
Эбулиоскопическая постоянная Эт этилового спирта равна 1,19 К×кг/моль (см. табл. 1); масса кислоты m(B) = 0,401 г; масса спирта
m(S) = 10,6 – 0,401 = 10,199 г. Подставим вуравнение (3а) цифровые значения и получим: М(В) = 1,19×0,401×1000/(0,337×10,199) = 138,8 г/моль.
Таблица 1
 2015-06-14
2015-06-14 4621
4621








