Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Например,
HNO3 «H+ + NO3–
Многоосновные кислоты диссоциируют ступенчато. Например сероводородная кислота диссоциирует ступенчато:
H2S «H+ + HS– (первая ступень)
HS– «H+ + S2– (вторая ступень)
Диссоциация многоосновных кислот протекает, главным образом, по первой ступени. Это объясняется тем, что энергия, которую нужно затратить для отрыва иона от нейтральной молекулы, минимальна и становится больше при диссоциации по каждой следующей ступени.
Основаниями называются электролиты, диссоциирующие в растворе, которые в качестве анионов образуют только гидроксид-ионы. Например,
NaOH ® Na+ + OH–
Многокислотные основания диссоциируют ступенчато
Mg(OH)2 «MgOH+ + OH– (первая ступень)
MgOH+ «Mg2+ + OH– (вторая ступень)
Ступенчатая диссоциация кислот и оснований объясняет образование кислых и основных солей.
Существуют электролиты, которые диссоциируют одновременно как основные и как кислотные. Они называются амфотерными.
H+ + RO– «ROH «R+ + OH–
Амфотерность объясняется малым различием прочности связей R–H и О–Н.
К амфотерным электролитам относятся вода, гидроксиды цинка, алюминия, хрома (III), олова (II, IV), свинца (II, IV) и др.
Диссоциацию амфотерного гидроксида, например Sn(OH)2, можно выразить уравнением:
2H+ + SnO22– «Sn(OH)2 «Sn2+ + 2OH–
+2H2O ¯ основные свойства
2H+ + [Sn(OH)4]2–
кислотные свойства
Солями называют электролиты, которые при диссоциации образуют катионы металлов, или комплексные катионы, и анионы кислотных остатков, или комплексные анионы.
Средние соли, растворимые в воде, диссоциируют практически полностью:
Al2(SO4)3 «2Al3+ + 2SO42–
(NH4)2CO3 «2NH4+ + CO32–
Кислые соли диссоциируют ступенчато, например:
NaHCO3 «Na+ + HCO3– (первая ступень)
Анионы кислых солей в дальнейшем диссоциируют незначительно:
HCO3– «H+ + CO32– (вторая ступень)
Диссоциацию основной соли можно выразить уравнением:
CuOHCl «CuOH+ + Cl– (первая ступень)
CuOH+ «Cu+2 + OH– (вторая ступень)
Катионы основных солей по второй ступени диссоциируют в незначительной степени.
Двойные соли – это электролиты, которые при диссоциации образуют два типа катионов металла. Например:
KAl(SO4)2 «K+ + Al3+ + 2SO42–.
Комплексные соли – это электролиты, при диссоциации которых образуются два типа ионов: простой и комплексный. Например:
Na2[Zn(OH)4] «2Na+ + [Zn(OH)4)]2–
Количественной характеристикой электролитической диссоциации является степень диссоциации a, равная отношению числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N)
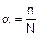
Степень диссоциации выражается в долях единицы или процентах.
По степени диссоциации все электролиты делятся на сильные (a>30%), слабые (a<3%) и средней силы (a - 3-30%).
Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся:
| Кислоты | HCl, HBr, HJ, HNO3, H2SO4, HClO3, HClO4, HMnO4, H2SeO4 |
| Основания | NaOH, KOH, LiOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2 |
| Соли | растворимые в воде (приложение, табл.2) |
Слабые электролиты частично диссоциируют на ионы при растворении в воде. К ним относятся вода, почти все органические кислоты (СН3СООН, HCOOR, H2C2O4 и др.), некоторые минеральные кислоты (HNO2, HCN, H2S, H2SiO3, H2CO3 и др.), гидроксид аммония NH4OH, а также все основания металлов, кроме оснований щелочных и щелочноземельных металлов.
 2015-06-04
2015-06-04 28775
28775