Уравнение Гиббса-Гельмгольца позволяет определять изменение энергии Гиббса, сопровождающее химические реакции при любой заданной температуре, если известна зависимость теплоты химических реакций от температуры.
Для вывода уравнения запишем ещё раз формулу, определяющую энергию Гиббса (III, 17):
G = H – TS
Из уравнения (III, 22) и теоремы 1 следует, что
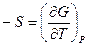 , тогда можно записать
, тогда можно записать
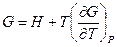
Полученное уравнение перепишем в следующем виде:
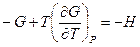
Разделим обе части полученного уравнения на Т2:
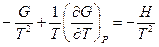
Нетрудно показать, что 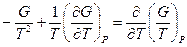 . Опуская индекс и заменяя частную производную на полную, получим:
. Опуская индекс и заменяя частную производную на полную, получим:
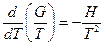
Для химической реакции это соотношение можно записать через изменение энергии Гиббса и энтальпии:
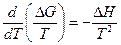 , ( III, 34 )
, ( III, 34 )
где 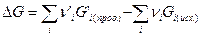
Выражение ( III, 34 ) и являетсяизвестным уравнением Гиббса-Гельмгольца.
Оно лежит в основе аналитического вычисления зависимости 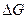 от температуры.
от температуры.
Перед рассмотрением использования этого уравнения условимся применять его преимущественно к стандартным условиям, что может быть учтено, если 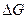 и
и 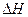 мы припишем соответствующие индексы:
мы припишем соответствующие индексы:
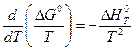 ( III, 35 )
( III, 35 )
Возьмем неопределенный интеграл соотношения ( III, 35 ):
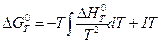 ,
,
где I – константа интегрирования, которая вычисляется для каждой конкретной реакции.
Чтобы вычислить интеграл в правой части полученного уравнения, подставим выражение для 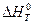 из формулы Кирхгофа (смотри (I, 67а)):
из формулы Кирхгофа (смотри (I, 67а)):
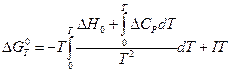 ( III, 36 )
( III, 36 )
Рассмотрим зависимость 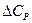 от температуры в двух приближениях:
от температуры в двух приближениях:
1. Теплоемкости исходных веществ и продуктов различны, но их разность постоянна, т.е. 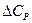 = const. Интегрирование уравнения ( III, 36 ) дает:
= const. Интегрирование уравнения ( III, 36 ) дает:
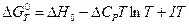
2. При необходимости получения более точной зависимости 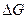 от Т принимают во внимание, что теплоемкости участников реакции зависят от температуры и их представляют в виде эмпирических степенных рядов (смотри (I, 15)). Тогда интегрирование ( III, 36 ) с учетом(I, 67б) дает:
от Т принимают во внимание, что теплоемкости участников реакции зависят от температуры и их представляют в виде эмпирических степенных рядов (смотри (I, 15)). Тогда интегрирование ( III, 36 ) с учетом(I, 67б) дает:
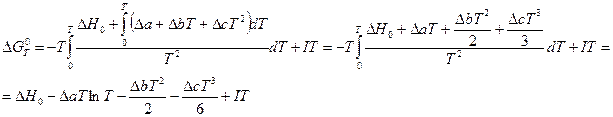 Константы данного уравнения
Константы данного уравнения 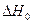 и I определяются из вычисленных значений
и I определяются из вычисленных значений 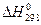 и
и 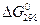 химической реакции, которые, в свою очередь, могут быть найдены с использованием известных стандартных теплот образования и энтропий всех участвующих в химическом превращении веществ.
химической реакции, которые, в свою очередь, могут быть найдены с использованием известных стандартных теплот образования и энтропий всех участвующих в химическом превращении веществ.
Анализ данных, полученных для различных процессов, показывает, что основная термодинамическая характеристика химической реакции 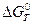 , вообще говоря, довольно сильно зависит от температуры. Нередко при достижении определенной температуры знак
, вообще говоря, довольно сильно зависит от температуры. Нередко при достижении определенной температуры знак 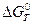 меняется на противоположный, значит, при этом происходит изменение направления самой реакции.
меняется на противоположный, значит, при этом происходит изменение направления самой реакции.
Например, стандартная энергия Гиббса реакции
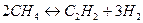
с повышением температуры изменяет знак с положительного на отрицательный при 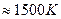 . Следовательно, в стандартных условиях выше указанной температуры реакция получения ацетилена из природного газа становится самопроизвольной и ее практическое осуществление оказывается возможным.
. Следовательно, в стандартных условиях выше указанной температуры реакция получения ацетилена из природного газа становится самопроизвольной и ее практическое осуществление оказывается возможным.
Вернемся еще раз к определению энергии Гиббса (смотри (III, 17)):
G = H – TS
Применив это выражение к изотермическому процессу при постоянном давлении, можем записать:
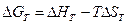
Эта формула полезна тем, что она указывает на изменение энтропийного члена
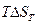 как на главную причину изменения
как на главную причину изменения 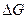 реакции с температурой. Иначе говоря, энергия Гиббса реакции тем сильнее зависит от температуры, чем больше в ходе реакции изменяется энтропия системы.
реакции с температурой. Иначе говоря, энергия Гиббса реакции тем сильнее зависит от температуры, чем больше в ходе реакции изменяется энтропия системы.
 2015-06-04
2015-06-04 11960
11960
