Методы исследования дисперсных систем (определение размера, формы и заряда частиц) основаны на изучении их особых свойств, обусловленных гетерогенностью и дисперсностью, в частности оптических. Коллоидные растворы обладают оптическими свойствами, отличающими их от настоящих растворов, – они поглощают и рассеивают проходящий через них свет. При боковом рассматривании дисперсной системы, через которую проходит узкий световой луч, внутри раствора на темном фоне виден светящийся голубоватый так называемый конус Тиндаля (рис. 5.5.). То же самое происходит, когда мы замечаем в пыльной комнате светлую полосу солнечного света из окна. Это явление называется опалесценцией.
 |
| Рис. 5.5. Эффект Тиндаля (опалесценция) |
Рассеяние света возможно, если размер коллоидной частицы меньше длины волны проходящего света и показатели преломления дисперсной фазы и дисперсионной среды различны. Размеры коллоидных частиц меньше длин волн видимой части спектра (примерно 0,1–0,2 длины волны света), и поглощенная световая энергия вновь испускается частицами в различных направлениях, что проявляется в рассеивании света. Интенсивность светорассеяния резко увеличивается с уменьшением длины световой волны.
Конус Тиндаля тем ярче, чем выше концентрация и больше размер частиц. Интенсивность светорассеяния усиливается при коротковолновом излучении и при значительном отличии показателей преломления дисперсной и дисперсионной фаз. С уменьшением диаметра частиц максимум поглощения смещается в коротковолновую часть спектра, и высокодисперсные системы рассеивают более короткие световые волны и поэтому имеют голубоватую окраску. На спектрах рассеяния света основаны методы определения размера и формы частиц.
Размеры частиц золей обычно равны 10–3–10–5 мм, что позволяет им участвовать в броуновском движении – непрерывном беспорядочном перемещении мельчайших частиц в жидкости или газе (рис. 5.6).
 |
| Рис. 5.6. Броуновское движение частицы |
Броуновское движение можно наблюдать при помощи микроскопа. Частица перемещается из-за различного числа одновременных ударов неодинаковой силы молекулами дисперсионной среды (рис. 5.7).
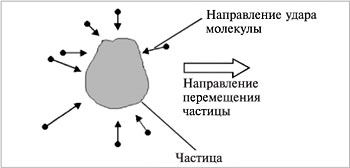 |
| Рис. 5.7. Перемещение частицы в дисперсионной среде |
Частицы дисперсных систем имеют различные размеры, и их распределение по размерам описывается кривыми, похожими на кривые распределения молекул газа по энергиям и скоростям. Распределение частиц дисперсной фазы по размерам показано на рис. 5.8.
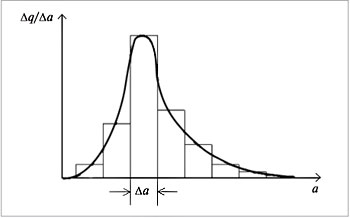 |
| Рис. 5.8. Кривая распределения частиц дисперсной фазы по размерам и ее построение |
Кривая этого распределения строится следующим образом. На оси абсцисс откладывают размер частиц а, на оси ординат – долю частиц 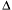 q /
q / 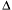 a, имеющих данный размер а. Интервал возможных размеров частиц делят на несколько равных диапазонов,
a, имеющих данный размер а. Интервал возможных размеров частиц делят на несколько равных диапазонов,  a, и определяют число частиц, имеющих размер, попадающий в данный диапазон. Для каждого диапазона строят прямоугольники с основанием
a, и определяют число частиц, имеющих размер, попадающий в данный диапазон. Для каждого диапазона строят прямоугольники с основанием  a и высотой
a и высотой 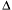 q /
q / 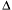 a. Далее соединяют середины верхних сторон прямоугольников и получают кривую распределения частиц по размерам.
a. Далее соединяют середины верхних сторон прямоугольников и получают кривую распределения частиц по размерам.
Площадь прямоугольника равна доле частиц, размеры которых лежат в диапазоне 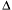 a, вся площадь под кривой распределения равна единице. Чем меньше диапазон
a, вся площадь под кривой распределения равна единице. Чем меньше диапазон 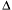 a, тем точнее кривая отражает распределение частиц по размерам. Подобного типа кривые могут быть симметричными, несимметричными (как на рис. 8.32) и даже с несколькими максимумами.
a, тем точнее кривая отражает распределение частиц по размерам. Подобного типа кривые могут быть симметричными, несимметричными (как на рис. 8.32) и даже с несколькими максимумами.
Броуновское движение препятствует седиментации (оседанию) частиц под действием силы тяжести и является одной из причин устойчивости дисперсных систем. Благодаря броуновскому движению частицы в зависимости от их массы (и плотности) распределяются в поле тяготения по высоте
(рис. 5.9). Такое распределение частиц называется седиментационным равновесием. Оно обнаруживается в жидких и воздушных средах. Внизу сосуда с жидкостью или водоема скапливаются частицы с большей массой.
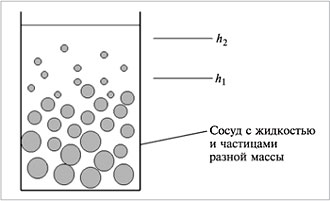 |
| Рис. 5.9. Седиментационное равновесие |
После выведения системы из седиментационного равновесия перемешиванием через некоторое время она снова возвратится в исходное состояние. Скорость установления седиментационного равновесия невысока, и оно может наступить через несколько дней, но затем будет сохраняться, пока не произойдет разрушения золя.
Если после установления седиментационного равновесия в химическом стакане (или водоеме) отбирать жидкость из тонкого слоя раствора между расстояниями h 2 и h 1 от дна (или от поверхности), то можно судить о числе и плотности частиц в различных слоях дисперсионной среды и выделить частицы с близкими размерами или плотностями.
Различают лиофильные и лиофобные золи. Лиофильные золи образуются самопроизвольно и не разрушаются со временем. Лиофобные золи постепенно разрушаются вследствие самопроизвольного слипания твердых частиц (коагуляция) или слияния жидких частиц (коалесценция), хотя при наличии стабилизатора эти процессы могут быть очень длительными.
Имеется много методов лабораторного и производственного получения коллоидных систем. Один из них состоит в образовании нерастворимых веществ в химической реакции (конденсационный метод). Например, при окислении сероводорода сера выделяется в коллоидном состоянии:
2H2S + O2 = 2S + 2H2O,
2H2S + SO2 = 3S + 2H2O,
2H2S + SO32– + 2Н+ = 3S + 3H2O.
Распад тиосульфат-иона в кислотной среде также приводит к образованию золя серы:
S2O32– = S + SO32–.
При гидролизе ионов Fe3+ образуется золь гидроксида железа:
Fe3+ + 3H2O = Fe(OH)3 + 3H+.
Эти и подобные им реакции проходят в природе при слиянии природных вод различных составов и кислотности.
Дисперсные вещества получают в лаборатории растиранием в ступках пестиком или в мельницах с шарами. В природе подобное случается при трении камней в быстрых потоках воды или на каменистых побережьях морей (вспомните форму гальки).
 2015-06-05
2015-06-05 5871
5871
