Экстремальные состояния - состояния, сопровождающиеся грубыми расстройствами метаболизма, жизненно важных функций и представляющие непосредственную опасность для жизни.
Экстремальные состояния часто связаны с действием сверхсильных патогенных факторов;
Виды экстремальных состояний: коллапс, обморок, шок, кома, терминальные состояния (иногда включаются). /. Понятие {(шок», стадии и патогенез шока. Шок - стадийно протекающее острое состояние, возникающее вследствие воздействия сверхсильных стрессоров и характеризующееся гиповолемией, снижением сердечного выброса и АД, нарушениями микроциркуляции и гипоксией. Стадии шока:
1. Эректильноя (напряжения) - сопровождается эмоциональным и поведенческирм возбуждением, активацией органов и систем.
2. Торпидная - угнетение психической, эмоциональной и поведенческой деятельности.
3. Терминальная,
Этиологическим фактором шока является любой сверхсильный раздражитель. Общий патогенез шока:
• Первичное звено - активация симапато-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем, что обуславливает симптомы эректильной фазы (поведение, увеличение силы и частоты сердечных сокращений, дыхания, усиление энергообмена, активация глюконеогенеза).
• Торможение (угнетение) ЦНС на начальном этапе охранительное, но при действии очень сильных раздражителей переходит в патологическое (запредельное), обуславливает торпидную фазу.
• «Централизация кровообращения» - циркуляция крови по системе "сердце-мозг-сердце". Необходимо для сохранения кровотока в жизненно важных органах и поддержания системного АД. Развивается в результате активации симапато-адреналовой системы (вазоконстрикция сосудов ос-органов [кожа, почки, органы брюшной полости], вазодилатация сосудов р-органов [сердце, мозг]).
• Основное звено патогенеза - гиповолемия (и падение АД) вследствие снижения сердечного выброса и недостаточной вазоконстрикции (приводит к нарушению микроциркуляции).
Гиповолемия - несоответствие между объемом сосудистого русла и объемом циркулирующей крови (проявлением ее чаще всего бывает I АД).
• Вазоконстрикция сосудов а-органов приводит к ишемическому стазу, вследствие чего
развивается гипоксия, ацидоз. Образующиеся при этом вазоактивные соединения вы
зывают неадекватную вазодилятацию, в результате которой формируется стаз, сладж,
ДВС-синдром, лежащие в основе «шоковых органов» (почки, легкие, печень).
/Л Основные виды шока.
1. Травматический шок представляет собой в большинстве случаев комбинацию болевого и геморрагического шоков.
2. Болевой шок - сильный болевой раздражитель -» запредельное торможение ЦНС -> распространение торможения на сосудодвигательный центр головного мозга -> нарушение регуляции сосудистого тонуса -> падение АД.
66
3. Геморрагический шок - гиповолемия обусловлена массивной кровопотерей.
4. Ожоговый шок возникает при поражении более 15% площади поверхности тела ожогами II степени и более. Причинами гиповолемии являются: потеря плазмы крови через ожоговую поверхность; снижение онкотического давления крови и потеря жидкой части крови из-за онкотических отеков; интоксикация (продукты распада поврежденных тканей, токсины микроорганизмов при присоединении инфекции); грубые изменения физико-химических свойств крови -> гемолиз эритроцитов.
5. Анафилактический шок - обусловлен нарушением иммунологической реактивности и развитием аллергической реакции I типа; взаимодействие аллергена с Ig Е, фиксированными на поверхности тучных клеток ~> высвобождение гистамина -> бронхоспазм (острая дыхательная недостаточность) + повышение проницаемости сосудов —> отек легких и выход жидкости за пределы сосудистого русла (гиповолемия). Смерть при анафилаксии наступает быстро именно из-за дыхательной недостаточности, выраженная гиповолемия простыне успевает сформироваться.
6. Гемотрансфузионный шок возникает при переливании несовместимой крови.-» массивная агглютинация и гемолиз эритроцитов -» гемическая гипоксия + высвобождение эритропластина (обладает активностью тромбопластина) -» развитие ДВС-синдрома.
7. Кардиогенный шок развивается при инфаркте миокарда, аритмиях, тампонаде сердца, тромбоэмболии легочной артерии (ТЭЛА).
Среди кардиогенных шоков выделяют три формы:
• Болевой шок.
• Истиный шок - обусловлен снижением насосной функции сердца из-за повреждения 50-65% миокарда.
• Аритмический шок возникает в связи со снижением насосной функции сердца из-за некоординированных сердечных сокращений.
8. Септический (эпдотоксический) шок обусловлен массивным выбросом фагоцитами
различных интерлейкинов, в первую очередь фактора некроза опухоли (ФИО), -» ди-
латация сосудов + повышение сосудистой проницаемости -» выход жидкости за пре
делы сосудистого русла. Кроме того, эндотоксины возбудителей активируют протео-
литические системы (калликреин-кининовую, фибринолитическую) -» ДВС-синдром.
9: Турникетный шок возникает при сдавлении мягких тканей более 4 часов, сопровождается «краш-синдромом», обусловлен болевым синдромом и интоксикацией продуктами распада после длительной ишемии (лактат, СО2, аденозин, тромбопластин), кроме того, миоглобин вызывает закупорку канальцев почки -» почечная недостаточность.
Оценка степени тяжести шока базируется на измерении величины артериального давления. Классификации тяжести шока могут различаться числом градаций и величинами АД. Принципиальными значениями являются величины систолического АД в диапазоне 50 - 70 мм рт. ст. При падении давления ниже 50 мм рт. ст. нарушается кровообращение жизненно важных органов (сердце, головной мозг, почки). Систолическое давление свыше 70 мм рт. ст. обеспечивает сохранность перфузии основных внутренних органов.
С учетом вышесказанного рекомендуется использовать четырехстепеннную классификацию тяжести шока по величине систолического АД:
I степень - систолическое АД до 90 мм рт. ст.
II степень - -//- до 70 мм рт. ст.
III степень - -//- до50ммрт.ст.
IV степень.- '-//- ниже 50 мм рт. ст.
С этой же целью может быть использован индекс Алговера, который рассчитывается как отношение частоты пульса к систолическому артериальному давлению.
I степень - индекс 0,6 - 1 (соответствует кровопотере около 10-15% от ОЦК)э
II степень - индекс 1 - 1,5 (-// - 20-35% от ОЦК),
III степень - индекс более 1,5 (-//- более 40 % от ОЦК).
Для оценки степени тяжести геморрагического шока с известным объемом кровопотери можно использовать классификацию, основанную на учете кровопоте ри:
I стадия - компенсированный шок - 15 - 25% ОЦК
II стадия - некомпенсированный шок - 25 - 45 % ОЦК
III стадия - необратимый шок - более 50 % ОЦК.
III. Понятия обморока и коллапса. Отличия от шока.
Коллапс ■ — остро возникающая сосудистая недостаточность, обусловленная первичным дефицитом вазоконстрикции, сопровождающаяся гиповолемией и падением АД.
Коллапс сопровождается расстройством сознания (например, «мушки» перед гла
зами). Потеря сознания при коллапсе свидетельствует о его переходе в обморок.
Обморок (синкопе, синкопальное состояние) - внезапная кратковременная потеря сознания, обусловленная недостаточностью церебрального биоокисления и гипоксией мозга.
Этиология коллапса и обморока:
1. Ортостатический коллапс и обморок - возникает при переходе из горизонтального
положения в вертикальное, обусловлен нарушением рефлекторной вегетативной регу
ляции АД.
В норме переход в вертикальное положение сопровождается оттоком крови от головы под действием силы тяжести. Падение АД в области каротидного синуса вызывает раздражение расположенных там барорецепторов и - рефлекторный спазм сосудов, благодаря чему кровоток в мозге сохраняется на необходимом уровне.
2. Панкреатический коллапс и обморок - возникает при заболеваниях поджелудочной
железы (панкреатит), сопровождающихся трипсинэмией.
Трипсин как протеолитический фермент активирует калликреин-кининовую систему, что вызывает увеличение продукции вазодилататорных пептидов (брадикинин) и, как следствие - снижение АД.
3. Энтерогенный коллапс и обморок - возникает при демпинг-синдроме (пострезекционный синдром) и обусловлен массивным поступлением вазодилататоров в кровь при быстрой эвакуации химуса в тонкий кишечник.
4. Гипоксемический обморок - обусловлен снижением напряжения О2 в крови при анемиях, голодании.
5. Тепловой и солнечный удар - обморок, вызванный дилатацией сосудов мозга при длительном тепловом воздействии.
6. Психогенный обморок - обусловлен значительной психогенной травмой, которая вы
зывает запредельное торможение в коре больших полушарий головного мозга —> рас
пространение торможения на сосудодвигательный центр —► нарушение регуляции со
судистого тонуса (дефицит вазоконстрикции) —► дилатация мозговых сосудов.
Коллапс и обморок - преходящие состояния, но при длительном действии фактора мо
гут переходить в шок.
IV. Кома. Этиология и патогенез отдельных видов ком (печеночная, уре
мическая, диабетическая).
Кома - полное выключение сознания с грубыми расстройствами рефлекторной сферы, вплоть до арефлексии и отсутствия болевой чувствительности. Коме может предшествовать ступор и сопор.
Ступор (оглушение) -расстройство сознания с сохранением словесного контакта.
 аш«в»ш*ш«^ШёшШШЩШШй«:=
аш«в»ш*ш«^ШёшШШЩШШй«:=
Сопор - выключение сознания с отсутствием словесного контакта и сохранением реакции на боль.
Иногда выделяют начальную стадию и прекому, которая характеризуется сонливостью (сомнеленция)
Основное звено патогенеза ком -угнетение ЦНС.
Комы делятся на экзогенные (рис. 2.8.1.); развивающиеся в исходе шоковых состояний и эндогенные (рис.2.8.2.) - обусловлены тяжелыми нарушениями при заболеваниях внутренних органов.
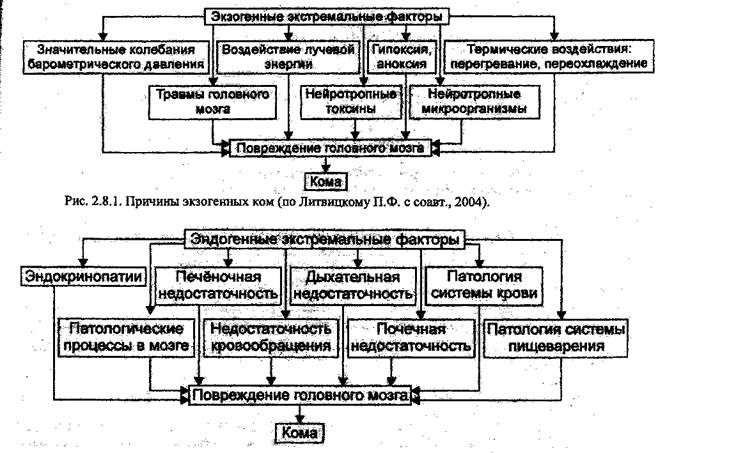
Рис. 2.8.2. Причины эндогенных ком (по Литвицкому П.Ф. с соавт, 2004).
Основные виды эндогенных ком Печеночные комы:
• Гепатоцеллюлярная кома вызывается интоксикацией производными аммония (в исходе гепатита или при интоксикации гепатотропными ядами). В норме производные аммония образуются в кишечнике и обезвреживаются в печени, превращаясь в нетоксичную мочевину. При гепатоцеллюлярной коме аммоний нарушает биоокисление в мозге -> развивается тканевая гипоксия мозга.
• Шунтовал кома обусловлена поступлением в кровоток и интоксикацией ЦНС продуктов гниения белков из кишечника (фенол, скатол и др. -> печеночный залах), которые в норме обезвреживаются в печени и выделяются почками. Возникает при портальной гипертензии (цирроз печени) -> высокое гидростатическое давление в портальной системе--> сброс крови в нижнюю полую вену по шунтам.
Уремическая кома обусловлена накоплением мочевины при заболеваниях почек и почечной недостаточности -> избыток выделяется слизистыми, в том числе и в кишечник -»
т
в кишечнике из мочевины образуется аммиак (уремический запах), который всасывается в кровь -» интоксикация ЦНС.
Диабетическая нома (кетоацидотинеская) обусловлена накоплением кетоновых тел ф-оксимасляная, ацетон и особо токсичная ацетоуксусная кислота) -> интоксикация и угнетение ЦНС.
Основные дифференциально-диагностические критерии различных форм экстремальных состояний представлены в таблице 2.8.1.
| признак может наблюдаться, |
| Таблица 2.8.1. Д | ифференциально-диагностические признаки экстремальных состояний. | ||||||
| Коллапс | Обморок | Шок, эрек-тильная стадия | Шок, торпедная стадия | Ступор | Сопор | Кома | |
| Потеря сознания | - | + | - | - | - | + | + |
| Нарушение сознания | - | - | + | + | + | - | - |
| Словесный контакт | + | - | + | + | + | - | - |
| Реакция на боль | + | + | +' | + | + | ............................. * ■ + | - |
| Сохранность рефлексов | + | + | + | + | + | + | - |
| Снижение АД, гиповолемия | + | + | + | + | + | + | -1- |
Примечание: «+» - признак характерен, «-» - признак не характерен, «±» «•» - выраженные нарушения болевой чувствительности.
2.9. Воспаление.
I. Виды воспаления в зависимости от причин, реактивности, течения, преобладания стадий. Стадии воспаления. Общие и местные признаки воспаления. Воспаление - типовой патологический процесс, защитно-приспособительная реакция, развивающаяся в ответ на действие флогогенного агента, направленная на устранение, локализацию этого агента и восстановление структуры ткани. Классификация воспаления: По участию микроорганизмов:
■ Инфекционное (септическое).
■ Неинфекционное (асептическое). По реактивности:
■ Гиперэргическое.
■ Нормэргическое.
■ Гипоэргическое. По течению:
■ Острое.
■ Подострое.
11 Хроническое. По преобладанию стадии:
■ Альтеративное (в последнее время отрицается).
■ Экссудативное (по характеру экссудата дифференцируется на крупозное, сероз
ное, фибринозное, гнойное, гнилостное, геморрагическое, катаральное, смешан
ное).
■ Пролиферативное (продуктивное).
Стадии воспаления:
I. Стадия альтерации (повреждение) бывает:
■ первичная,
■ вторичная.
П. Стадия экссудации в неё входят:
■ сосудистые реакции,
■ собственно экссудация,
■ маргинация и эмиграция лейкоцитов,
■ внесосудистые реакции (хемотаксис и фагоцитоз).
III. Стадия пролиферации (восстановление поврежденных тканей):
Аутохтонность - это свойство воспаления раз начавшись, протекать через все стадии до логического завершения (включается каскадный механизм, когда предыдущая стадия порождает последующую).
Местные признаки воспаления:
1. Покраснение (гиЪог) связано с развитием артериальной гиперемии и "артериализа-цией" венозной крови в очаге воспаления.
2. Жар (со1ог) обусловлен увеличенным притоком теплой крови, активацией метаболизма, разобщением процессов биологического окисления.
3. "Опухоль" ("припухлость", Штог) возникает вследствие развития экссудации и отека, набухания тканевых элементов, увеличения суммарного диаметра сосудистого русла,в очаге воспаления.
4. Боль (йо1ог) развивается в результате раздражения нервных окончаний различными биологически активньми веществами (гистамин, серотонин, брадикинин и др.), сдвига активной реакции среды в кислую сторону, возникновения дисиоиии, повышения осмотического давления и механического растяжения или сдавления тканей.
5. Нарушение функции воспаленного органа (functio laesa) связано с расстройством его нейроэндокринной регуляции, развитием боли, структурными повреждениями.
Общие признаки воспаления:
1. Изменение количества лейкоцитов в периферической крови: лейкоцитоз или значительно реже - лейкопения. Лейкоцитоз обусловлен активацией лейкопоэза и перераспределением лейкоцитов в кровеносном русле. К числу основных причин его развития относятся стимуляция симпатической активности, воздействие некоторых бактериальных токсинов, продуктов тканевого распада, а также ряда медиаторов воспаления (ИЛ1 фактор индукции моноцитопоэза и др.).
2. Лихорадка развивается под влиянием поступающих из очага воспаления пироген-ных факторов, таких как липополисахариды, катионные белки, ИЛ1 и др.
3. Изменение белкового "профиля"' крови выражается в том, что при остром процессе в крови накапливаются синтезируемые печенью так называемые "белки острой фазы" (БОФ) воспаления - С-реактивный белок, церулоплазмин, гаптоглобин, компоненты комплемента и др. Для хронического течения воспаления характерно увеличение в крови содержания а- и особенно у-глобулинов.
4. Изменения ферментного состава крови выражаются в увеличении активности трансаминаз (аланинтрансаминаза - при гепатите; аспартаттрансаминаза - при миокардите), гиалуронидазы, тромбокиназы и т.д.
5. Увеличение скорости оседания эритроцитов (СОЭ) из-за снижения отрицательного заряда эритроцитов, повышения вязкости крови, агломерации эритроцитов, изменения белкового спектра крови, подъема температуры.
6. Изменения содержания гормонов в крови заключаются, как правило, в увеличении концентрации катехоламинов, кортикостероидов.
7. Изменения в иммунной системе выражаются в нарастании титра антител, появлении сенсибилизированных лимфоцитов в крови, развитии местных и общих аллергических реакций.
//. Механизмы первичной и вторичной альтерации. Медиаторы воспаления, их происхождение и основные эффекты.
Первичная альтерация вызывается непосредственным действием повреждающего агента. Для неё характерны ацидоз повреждения, снижение макроэргов, нарушение работы насосов, накопление недоокисленных продуктов, изменение рН, повышение проницаемости мембранных структур, набухание клетки.
Вторичная альтерация возникает в динамике воспалительного процесса и обусловлена как воздействием флогогенного агента, так и факторов первичной альтерации (в основном нарушениями кровообращения). Для неё характерно непосредственное воздействие лизосомальных ферментов (гидролазы, фосфолипазы, пептидазы, коллагеназы и т.д.), их повреждающее влияние. Опосредованное действие оказывают медиаторы, система комплемента, кининовая система.
Проявления альтерации:
1. Нарушение биоэнергетических процессов в тканях, ацидоз.
2. Нарушение транспортных систем в поврежденной ткани (повреждение мембран, недостаток АТФ, необходимой для функционирования энергозависимых мембранных каналов)
3. Повреждение мембран лизосом и высвобождение ферменов, способных разрушить любые органические субстраты (образование новых биологически активных веществ, потенцирование альтерации до летальных повреждений клеток).
Большую роль в механизме воспаления играют медиаторы. Их делят на: провоспали-тельные и противовоспалительные, локальные (тканевые), циркулирующие и промежуточные.
1. Локальные (тканевые) медиаторы:
а) Гистамин выбрасывается при дегрануляции тучных клеток (расширение сосудов
микроциркуляторного русла, повышение проницаемости микрососудов).
Ь) Серотонин может выделяться из тучных клеток, но главным его источником являются тромбоциты (медиатор боли, сосудистые эффекты меняются в зависимости от количества: в физиологических условиях является вазоконстриктором; в высоких концентрациях, при воспалении, - вазодилататором, повышает проницаемость сосудов).
с) Простагландины - это местные гормоны, модуляторы клеточных процессов, коротко живущий чрезвычайно химически активный класс.
■ простагландины класса Е (Еь Е2) расширяют сосуды, повышают их проницаемости, являются медиаторами боли;
■ простагландины класса Р обладают противовоспалительным эффектом;
■ простациклин (простагландин I2), его источником являются тромбоциты (расширяет сосуды, препятствует тромбообразованию).
■ тромбоксан (стимулирует тромбообразование, вызывает вазоконстрикцию, способствует агрегации клеток крови).
б) Лейкотриены образуются в нейтрофилах, эозинофилах, Т-лимфоцитах (стимули
руют хемотаксис, особенно активен лейкотриен В4).
2. Циркулирующие медиаторы (образуются из неактивных белковых предшественников):
е) Кинины (брадикинин и калидин) образуются из кининогенов под действием ферментов калликреинов. Брадикинин и калидин способствуют расширению микрососудов, повышению проницаемости. Брадикинин является важнейшим медиатором боли.
1) Система комплемента- отдельные элементы этой системы по-разному влияют на развитие воспаления. Хемотаксическим эффектом обладают Сз и С5 компоненты.
Кроме того, компоненты комплемента опосредовано влияют на проницаемость сосудистой стенки, и имеется их взаимосвязь с системой кининов. g) Система гемостаза и особенно фактор Хагемана относятся к пусковому механизму свертывания крови. Фактор Хагемана при воспалении активирует коагуляцию, кининогенез и систему комплемента, кроме того, он регулирует активность фибринолитической системы. 3. Промежуточные медиаторы:
Приносятся в очаг воспаления лейкоцитами. В очаг воспаления поступают нейтро-филы (микрофаги), они высвобождают лизосомальные ферменты, простагландины. Медиаторы, которые выделяют моноциты, объединены общим терминов монокины. Они высвобождают также защитные белки: интерфероны, стимуляторы иммунной системы - ин-терлейкины. Лимфоциты высвобождают лимфокины.
Иногда медиаторы называют собирательно (в зависимости от клетки-источника): лейкокины, монокины.
Классификация медиаторов по химической структуре:
I. Биогенные амины - самые ранние медиаторы (гистамин, адреналин, серотонин,
полиамины - спермин, путресцин).
1. Гистамин образуется в тучных клетках из гистидина под влиянием гистидин-декарбоксилазы и находится в гранулах.
2. Серотонин (5-гидрокситриптамин) образуется при декарбоксилировании триптофана, в основном в клетках энтерохромафинной системы (ЖКТ, мозг), выделяется в основном из тромбоцитов.
3. Катехоламины играют значительную роль при стрессе.
4. Полиамины (путресцин, спермин) стимулируют пролиферацию.
II. Пептиды (олигопептиды и белки)
1. Калликренин-кининовая система.
3. Система комплемента - система сывороточных белков, обозначающихся С1-С9, имеющих каскадный принцип активации. При этом наблюдается повреждение мембран, дегрануляция, хемотаксис, маргинация, опсонизация. Альтернативный путь можно увидеть при рассмотрении Сз, С5.
4. Свертывающая и фибринолитическая системы.
5. Лейкокинины - пептиды некининового происхождения, образующиеся из фрагментов иммуноглобулинов под влиянием нейтрофильной и макрофагальной лейко-кининогеназы. Тафтсин стимулирует фагоцитоз, пролиферацию Т-лимфоцитов
6. Лимфо- и монокины. Интерлейкины играют важную роль в пирогении, оказывают стимуляцию пролиферации. Интерфероны имеют противовирусную активность, стимулируют фагоцитоз.
7. Лизоцим обладает бактерицидным эффектом.
III. Липидные медиаторы.
1. Простагландины - их делят на констрикторы (действуют через кальцевые каналы) и дилятаторы (действуют через систему аденилатциклазы) сосудов, они по-разному влияют на гемостаз (агрегация тромбоцитов). Тромбоксан (А2), простациклин (I2), простагландин Е.
2. Лейкотриены - участвуют в хемотаксисе, увеличении проницаемости мембран.
3. Фактор активации тромбоцитов - способствует маргинации.
IV. Другие группы: гепарин, перекиси, свободные радикалы (оксид азота, супероксид
ный радикал).
Основные медиаторы альтерации:
• Система комплемента.
• Свободные радикалы.
///. Механизмы экссудации: Основные медиаторы экссудации:
• Гиетамин.
• Кийины.
• Серотонин.
• Простагландины. Сосудистые реакции:
Ишемия - ангиоспаетическая кратковременная (из-за разрушения адреналина и но-
радреналина под влиянием МАО и КОМТ), возможна обтурационная вследствие
тромбоза. Артериальная гиперемия обуславливает развитие одного из классических признаков
воспаления (гаЬог) - красноты. Возможны все механизмы артериальной гипепере-
мии. Смешанная гиперемия. Венозная гиперемия - повышение проницаемости капилляров -> скопление жидкости
в интерстиции -» сдавление венул и лимфатических капилляров. Классический
признак - отек (tumor). Последствия:
■ Сгущение крови и повышение вязкости.
■ Активация гемостаза, адгезия и агрегация форменных элементов (монетные столбики, сладж), образование микротромбов, изменение физико-химических свойств крови, появление в крови некоторых белков (глобулины острой фазы), понижение альбумин-глобулинового коэффициента.
■ Маргинация (краевое стояние) лейкоцитов.
■ Набухание эндотелиальных клеток.
Стаз способствует гиперкоагуляции и тромбозу; возможны все виды стаза. Собственно экссудация:
Экстравазация жидкости из-за увеличения проницаемости сосудистой стенки. Другими словами происходит: разрушение стенки сосудов при альтерации; округление эндотелиальных клеток и появление межклеточных щелей (гистамин, брадикинин); мик-ровизикуляция эндотелия - эндоцитоз и трансцитоз компонентов плазмы; раздвигание эндотедиальных клеток лейкоцитами по типу "расстёгивание молнии"; увеличение фильтрационного давления и площади фильтрации.
Различают раннюю экссудацию, 5-30 мин. (действие биогенных аминов и ацетил-холина на посткапиллярные венулы) и позднюю экссудацию, от 1 часа до 7 суток (действие полипептидных и липидных медиаторов на венулы и капилляры). Также происходит выход форменных элементов. Отличием экссудата от транссудата является наличие более 2-3% белка.
Эмиграция:
1. Экстравазация форменных элементов - маргинация лейкоцитов, которая объясняется изменением заряда поврежденных клеток, фиксацией в межэндотелиальных щелях - "ловушках", движением с током жидкости, образованием мостиков, влиянием медиаторов (фибронектин, компоненты системы комплемента, XII фактор, каллекреин, брадикинин).
2. Движение лейкоцитов через сосудистую стенку. Лимфоциты и моноциты проникают через эндотелиальные клетки, не повреждая их. Полиморфноядерные лейкоциты - через эндотелиальные щели.
3. Движение клеток из сосуда в очаг воспаления по градиенту хемотаксинов называется хемотаксисом, в случае если это движение без градиента и беспорядочно - хемокинезоы.
Способность привлекать в очаг воспаления лейкоциты называется хемоамтракци-ещ ею обладают хемоаттрактанты (различные цитокины, микроорганизмы и продукты
их жизнидеятельности, система комплемента, некротаксины - деграданты коллагена, фиб-ронектин (гной лейкоцитов), иммунные комплексы).
Хемоаттрактанты воспринимаются рецепторами лейкоцитов. Движение лейкоцитов обеспечивается структурами цитоскелета: микрофиламетами и микротрубочками. При участии Са++ и Са-связывающего белка гельзолина, актина цитоскелета. Желатини-зация актина сопряжена с сокращением элементов цитоскелета.
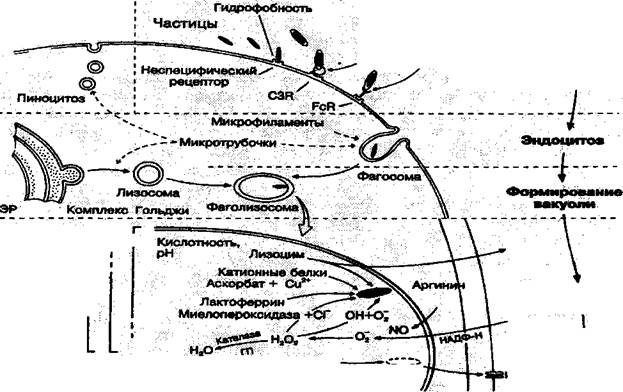
//У, Стадии и механизмы Фагоцитоза.. "' Стадии фагоцитоза (рис 2.9.1):
1. Приближение (случайное и хемотаксис).
2. Контакт, распознавание и прилипание.
В процессе распознавания большую роль играет опсонизация - покрытие объекта фагоцитоза сыворочными факторами - опсонинами (антителами 1дО, М и Е «метят» объекты, подлежащие элиминации).
Прилипание осуществляется посредством связи опсонинов с рецепторами фагоцитов. Завершенный фагоцитоз идет только с участием опсонинов.
3. Поглощение (механизм: псевдоподии -» фагосомы -» фаголизосомы).
При поглощении живые микроорганизмы сначала должны быть убиты. В лейкоцитах существует 2 бактерицидных механизма:
■ зависящий от кислорода (связан с образованием активных метаболитов кислорода, продукция которых начинается после контакта фагоцитов с опсонизиро-ванными бактериями);
■ независящий от кислорода (связан с дегрануляцией и поступлением внутрь фагосомы бактерицидных веществ, которые содержатся во внутриклеточных гранулах фагоцитов - лизоцим, лактоферрин и др.).
4. Переваривание за счёт сильных эндогенных окислителей и ферментов, таких как
гидролазы, комплемент, лизоцим, аргиназа.
| Растворённый в жидкости материал |
| Опсонизация Антитело |
| Хемотаксис Присоединение |
| Нейтрофил я -4 Моноцит — Макрофаг—Г |
| Разрушение Кислород Переваривание ГКГС II |
 Протеолитические-
Протеолитические-
ферменты
Рис. 2.9.1. Схема фагоцитоза.
Некоторые микроорганизмы (микобактерии, трипаносомы, лиетерии, сальмонеллы) ингибируют образование фаголизосом и возбудители персистируют в фагоците. Они сохраняются, оказываясь при этом «отгороженными» мембраной и цитоплазмой фагоцитов от противомикробных лекарств. Последняя (4-я) стадия фагоцитоза не развивается, формируется незавершенный фагоцитоз.
Причины незавершенного фагоцитоза: дефицит белка; дефицит витаминов; наследственные ферментопатии; иммунодефициты; особенности возбудителя (его размеры значительно превышают размеры самого фагоцита); объектом фагоцитоза являются комплексы антиген-антитело, находящиеся на плоской поверхности сосудистого эндотелия.
V. Механизмы пролиферации.
Пролиферация - репаративная стадия воспаления (размножение клеток, восстановление структуры межклеточного пространства).
Фибробласты - главные эффекторы репарации. Механизм - стимуляция пролиферации через синтез ДНК и митотическую активность.
Репарация начинается с 1 стадии воспаления и достигает пика в 3 стадию. Медиаторы, стимулирующие пролиферацию (трефоны): Ь Полиамины - путресцин, спермидин (продукты орнитиндекарбоксилазы). \.
2. Факторы роста фибробластов - тромбоцитарный и гапофизарный.
3. Эндотелиальный хемотаксический фактор (из макрофагов) - для врастания сосудов в грануляционную ткань.
4. Тканеспецифические стимуляторы - иммуноглобулины О и М.
5. Лимфокины (из Т-лимфоцитов) участвуют в пролиферации лимфоцитов и макрофагов.
6. Монокины (из макрофагов).
7. Эндотелиальный фактор роста.
Кейлоны - медиаторы, ингибирующие пролиферацию.
Эффекты кейлонов потенцируют адреналин, глюкокортикоиды, цАМФ; трефонов -
альдостерон, цГМФ.
VI Хроническое воспаление. Гранулема.
Хроническое воспаление развивается, когда повреждающий агент действует длительное время, или первично (при аллергических и аутоиммунных болезнях), и характеризуется преобладанием процессов пролиферации. Причины хронизации воспаления;
1. Слабая реактивность, чаще у детей и стариков.
2. Слабые сосудистые реакции.
3. Незавершённый фагоцитоз.
4. Устойчивые микроорганизмы (при туберкулёзе, проказе, листериозе, токсикоплаз-мозе).
5. Неперевариваемые объекты - инородные тела (металл, древесина).
Гранулематозное воспаление - хроническое воспаление, вызванное нераствори
мыми или медленно разрушающимися (персистирующими) раздражителями и сопровож
дающееся образованием гранулем, возникающих в результате пролиферации и трансфор
мации способных к фагоцитозу клеток.
Этиологические факторы гранулематозного воспаления:
1. Эндогенные:
■ труднорастворимые продукты повреждения тканей, в первую очередь жировой ткани (мыла);
■ продукты нарушенного обмена (ураты);
2. Экзогенные:
■ биологические факторы (бактерии, грибы, простейшие, гельминты и т. д.);
■ органические и неорганические вещества (при пылевых болезнях - силикоз, талькоз, асбестоз, биссиноз и др.), в том числе лекарственные средства (гра-нулематозный гепатит, олеогранулематозная болезнь). Длительно раздражённые макрофаги выделяют монокины, которые и формируют гранулёму.
Гранулемы представляют собой компактное скопление макрофагов, эпителиоид-ных клеток, могут присутствовать лимфоциты, плазматические клетки, нейтрофильные и/или эозинофильные гранулоциты, фибробласты (склероз). Морфогенез гранулемы складывается из 4 стадий:
1. Накопление в очаге повреждения ткани юных моноцитарных фагоцитов;
2. Созревание этих клеток в макрофаги и образование макрофагальной гранулемы;
3. Созревание и трансформация моноцитарных фагоцитов и макрофагов в эпителио-идные клетки и образование эпителиоидной клеточной гранулемы;
4. Слияние эпителиоидных клеток (или макрофагов) и образование гигантских клеток (клеток инородных тел или клеток Пирогова-Лангханса) и эпителиоидно-клеточной или гигантоклеточной гранулемы. Гигантские клетки характеризуются значительным полиморфизмом: от 2-3-ядерных до гигантских симпластов, содержащих 100 ядер и более. В гигантских клетках инородных тел ядра располагаются в цитоплазме равномерно, в клетках Пирогова-Лангханса - преимущественно по периферии. Диаметр гранулем, как правило, не превышает 1-2 мм; чаще они обнаруживаются лишь под микроскопом. Исходом гранулемы является склероз.
VII. Методы диагностики воспалительных процессов.
Диагностика воспаления основывается на комплексе клинических, инструментальных и лабораторных методов исследования. Установление наличия воспаления в организме начинается, как правило, с его классических признаков (tumor, rubor, са1ог, dо1оr, functio lease). Однако, в случае патологии внутренних органов, далеко не все эти симптомы доступны для исследования.
Увеличение размера воспаленного органа (tumor) или наличие экссудата помогает установить рентгенологическое или ультразвуковое исследование. Кроме того, при ультразвуковом исследовании могут быть выявлены и другие признаки воспаления: утолщение стенок полого органа, изменение эхогенности (способности к отражению ультразвука).
Допплеровские ультразвуковые методы исследования (ультразвуковая допплеро-графия, цветное дуплексное сканирование) могут выявить характерные для воспаления нарушения регионального кровообращения (артериальная и венозная гиперемия, стаз).
Тепловидение в инфракрасном диапазоне помогает установить локализацию воспаления по местному увеличению поверхностной температуры в проекции пораженного органа, а в радиочастотном диапазоне и непосредственно в органе.
Важным для диагностики выраженности воспалительной реакции является установление нарушения функции поврежденного органа методами функциональной диагностики. Например, нарушение функции внешнего дыхания при пневмонии с помощью спи-роанализа, нарушение сократительной функции сердца при миокардите с помощью эхо-допплеркардиографии.
Поскольку в основе воспаления лежит повреждение клеток, для диагностики и установления локализации процесса используется исследование ферментов - маркеров повреждения, например, аспартатаминотрасфераз и аланинаминотрансфераз.
Большое значение для диагностики воспаления имеет исследование белой крови. Деструкция ткани при остром и особенно при инфекционном воспалении, сопровождается появлением в крови большого количества лейкопоэтинов, которые способствуют активации лейкопоэза, в результате в периферической крови выявляется лейкоцитоз и сдвиг лейкоцитарной формулы влево. Хронизация процесса в большей степени стимулирует рост
числа мононуклеарных лейкоцитов. Имеющаяся при этом интоксикация может проявиться в виде дегенеративных изменений гранулоцитов (токсическая зернистость, гиперсегментация, кариопикноз и т. д.). Однако, концентрация лейкоцитов в периферической крови при воспалении повышается далеко не всегда. Во-первых, хроническое или даже острое воспаление может сопровождаться токсическим действием на красный костный мозг продуктов воспаления. Во-вторых, усиленный лейкопоэз может маскироваться повышением адгезивных свойств лейкоцитов и эндотелия сосудов, что приводит в возрастанию процента маргинальных лейкоцитов. В третьих, возможно повышенное выделение лейкоцитов из организма, например, через свищевые ходы абсцесса.
Прогноз воспаления можно предположить но показателям функции лейкоцитов в тестах исследования активности их миграции в зону повреждения, спонтанной и стимулированной фагоцитарной активности, уровню секреции в кровь цитокинов.
Важным диагностическим признаком воспаления является диспротеинемия. При остром воспалении она возникает вследствие увеличения в крови концентрации белков острой фазы (альфа-1 и альфа-2 глобулиновая фракция). При хроническом воспалении -за счет увеличения синтеза белков гамма-глобулиновой фракции. В таблице 2.9.1 представлены примеры изменений соотношения белковых фракций сыворотки крови при воспалении.
| Таблица 2.9.1. Белковые фракции сыворотки крови (в( | Уо) | ||
| Норма | Острое воспаление | Хроническое воспаление | |
| Альбумины | 46,9-61,4 | ||
| \ а-1-глобулины | 2,2 - 4,4 | ||
| а-2-глобулины | 7,9-10,9 | ||
| р-глобулины^ | 10,2-18,3 | ||
| у-глобулины | 17,6-25,4 |
Диспротеинемия дает еще один важный признак воспаления - повышение СОЭ за счет нейтрализации мембранного заряда эритроцитов белками воспаления и снижения вследствие этого взаимоотталкивания клеток при оседании. Однако при этом необходимо учитывать другие возможные причины ускорения СОЭ, например, наличие эритропении или опухолевого процесса.
Особое значение в диагностике воспаления придается исследованию концентрации в крови белков острой фазы, которые усиленно синтезируются в ответ на повреждение или стресс, возникающий при воспалении. К белкам острой фазы относятся белки, участвующие в гемостазе (фибриноген, плазминоген), транспортные белки (церуллоплазмин, гаптоглобин, орозомукоид), опсонины (С-реактивный белок), антиферменты (альфа-1-антитрипсин, альфа-1-антихимотрипсин, альфа-2 макроглобулин), белки системы комплемента, сывороточный амилоидный протеин и другие (табл. 2.9.2). Непосредственными стимуляторами их синтеза являются цитокины фагоцитов, прежде всего ИЛ-1 и 6, а также фактор некроза опухолей (ФНО). Диагностическая ценность определения различных белков острой фазы неодинакова.
Наиболее чувствительным маркером воспаления является сывороточный амилоидный протеин. Правда, и здесь возможен ложноположительный результат, так как он входит в состав липопротеинов высокой плотности и его титр повышается при некоторых дислипопротеинемиях. Вторым по чувствительности, но первым по популярности является С-реактивный белок. К сожалению, титры его весьма вариабельны, поэтому диагностическая ценность этого показателя особенно велика не при однократном, а при динамичном исследовании. Далее по значимости можно поставить антихимотрипсин, церулоплаз-мин и орозомукоид. Другие острофазные белки надо оценивать с большой осторожностью из-за возможности артефакта. Так, достаточно часто встречается врожденная недостаточность антитрипсина, что, кстати, предрасполагает к хроническим воспалениям, Гап-
тоглобин и фибриноген значительно потребляются в процессе воспаления и покидают кровяное русло.
| Сывороточный амилоидный протеин | . 1,0-3.0 г/д |
| С - реактивный белок | 0,1-8,0 мг/л |
| Антихимотрипсин | 0,2-0,5 г/л | |
| Антитрипсин | 2,0-4,0 г/л |
| Церулоплазмин | 0,2-0,5 г/л |
| Трансферрин | 1,7-4,0 г/л |
| Фибриноген | 2-4,5 г/л |
Ценным для диагностики воспаления является исследование экссудата. Поскольку многие отеки и водянки могут быть невоспалительного происхождения, такой признак воспаления как припухлость, требует дифференциальной диагностики экссудата и транссудата по классическим отличительным признакам (рН, концентрации белка и клеточному составу). Нормальная величина рН в межклеточной жидкости равна 7,34. В очаге воспаления, вследствие гипоксии, повреждения митохондрий, накопления лейкоцитов, нарастает ацидоз. Величина рН экссудата при этом снижается при хроническом воспалении до рН 7,1 - 6,6, а при остром, особенно гнойном воспалении до рН 6,5 - 5,4. Концентрация белка в транссудате обычно невелика (не превышает 2 - 3%), он достаточно прозрачен, присутствуют единичные полиморфноядерные лейкоциты. В экссудате по мере повышения капиллярной проницаемости и разрушения клеток возрастает концентрация белка, появляется даже крупномолекулярный белок - фибриноген, привлекается все больше лейкоцитов, иногда появляются эритроциты, исчезает прозрачность.
 2015-06-05
2015-06-05 7210
7210
