1. Закончить уравнения реакций и уравнять их используя метод электронного баланса. Указать окислитель и восстановитель:
а) Pb + HNO3 конц →
б) S + HNO3 конц →
в) P + H2SO4 конц →
г) Mg + H2SO4 конц →
а) Металл + НNО3(конц) → соль + оксид азота + Н2О
Формула оксида азота зависит от активности металла:
- в основном выделится N2O, если в реакцию вступает активный металл (стоящий в ряду стандартных электродных потенциалов в интервале Li...Al);
- в основном выделится NО, если в реакцию вступает металл средней активности (Mn...Рb);
- в основном выделится NO2, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
| Дано: а) Pb + HNO3 конц → б) S + HNO3 конц → в) P + H2SO4 конц → г) Mg + H2SO4 конц → |
| Уравнять реакции и указать окислитель и восстановитель |
РЕШЕНИЕ:
а) Pb0 + HN+5O3 конц =
восст. окисл.
= Pb+2(NO3)2 + N+2O + H2O
НОК ДМ

 восст-ль Pb0 - 2? = Pb+2 3
восст-ль Pb0 - 2? = Pb+2 3
окисл-ль N+5 + 3? = N+2 2

3Pb0 + 2N+5 = 3Pb+2 + 2N+2
Переносим полученные коэффициенты в молекулярное уравнение:
 3Pb0 + 2HN+5O3(конц) = 3Pb+2(N+5O3)2 + 2N+2O + H2O
3Pb0 + 2HN+5O3(конц) = 3Pb+2(N+5O3)2 + 2N+2O + H2O
 |
Поскольку азотная кислота расходуется не только на получение 2 моль NO, но и на получения 3 моль Pb(NO3)2, в которых содержится 6NO 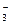 со степенью окисления N+5, то для протекания этого процесса необходимо дополнительно 6 моль HNO3.
со степенью окисления N+5, то для протекания этого процесса необходимо дополнительно 6 моль HNO3.
 |
 6HNO3 (конц) + 3Pb + 2HNO3(конц) = 3Pb(NO3)2 + 2NO + H2O
6HNO3 (конц) + 3Pb + 2HNO3(конц) = 3Pb(NO3)2 + 2NO + H2O
 |
Суммируем число моль HNO3 и уравниваем количество водорода и кислорода (4Н2О):
3Рb + 8HNO3(конц) = 3Pb(NO3)2 +2NO + 4Н2О.
б) Неметалл + HNO3(конц) → кислота, в которой неметалл проявляет высшую степень окисления + NO2 + (Н2О):
B → H3B+3O3; P → H3P+5O4; S → H2S+6O4; Se → H2Se+6O4;
Si → H2Si+4O3; C → H2C+4O3; As → H3As+5O4.
РЕШЕНИЕ:
б) So + HN+5O3(конц) = Н2S+6O4 + N+4O2 + H2O
восст. окисл.

 НОК ДМ
НОК ДМ
восст-ль S0 - 6? = S+6 1
окисл-ль N+5 + ? = N+4 6
 |
S0 + 6N+5 = S+6 + 6N+4
S + 6HNO3(конц) = Н2SO4 + 6NO2 + 2H2O
в) Неметалл + H2SO4(конц) → кислота, в которой неметалл проявляет высшую степень окисления + SO2 +(Н2O)
РЕШЕНИЕ:
в) P0 + H2S+6O4(конц) = Н3Р+5О4 + S+4O2 + H2O
восст. окисл.

 НОК ДМ
НОК ДМ
восст-ль P0 - 5? = P+5 2
окисл-ль S+6 + 2? = S+4 5
 |
2Р0 + 5S+6 = 2P+5 + 5S+4
2P + 5H2SO4(конц) = 2Н3РО4 + 5SO2 + 2H2O
г) Металл + H2SO4(конц) → соль + (H2S, S, SO2)
(в зависимости от активности металла) + Н2О.
- H2S выделится, если в реакцию вступает активный металл (Li...Al),
- S выделится, если в реакцию вступает металл средней активности (Mn...Рb),
- SO2выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
РЕШЕНИЕ:
г) Mg0 + H2S+6O4(конц) = Mg+2SO4 + H2S-2 + H2O
восст. oкисл.
НОК ДМ

 восст-ль Mg0 - 2? = Mg+2 4
восст-ль Mg0 - 2? = Mg+2 4
окисл-ль S+6 + 8? = S-2 1
 4Mg0 + S+6 = 4Mg+2 + S-2
4Mg0 + S+6 = 4Mg+2 + S-2
Аналогично примеру (а) уравниваем реакцию:
 |
4H2SO4(конц) + 4Mg + H2SO4(конц) = 4MgSО4 + H2S + 4H2O

4Mg + 5H2SO4(конц) = 4MgSО4 + H2S + 4H2O
 2015-06-05
2015-06-05 4411
4411
