1. Составить ионно-молекулярное и молекулярное уравнения гидролиза карбоната калия (K2CO3). Вычислить константу, степень и рН гидролиза соли в 0,01М растворе.
| РЕШЕНИЕ: |
 |
K2 CO3 + H2O <=> KHCO3 + KOH
 KOH + H2 CO3
KOH + H2 CO3
|
|

 СО32 - + Н ОН <=> +, рН>7, среда
СО32 - + Н ОН <=> +, рН>7, среда
 щелочная
щелочная
Kг = 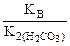 ,
,
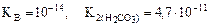 (табл.).
(табл.).
Kг = 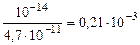 ,
,
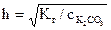 ,
, 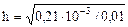 =0,14,
=0,14,
pH+ рОН=14.
Так как среда щелочная, то определяем 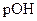 :
:
pОН= -1/2∙lgKг -1/2∙lg 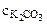 =
=
= 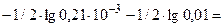 2,84
2,84
рН = 14-рОН, рН = 14-2,84=11,16,
Ответ: 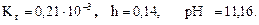
2. Рассчитать при температуре 300К константу, степень и рН гидролиза нитрат аммония (NH4NO3) в 1М растворе, используя значения термодинамических характеристик реакции гидролиза соли. Написать ионно-молекулярное и молекулярное уравнение гидролиза этой соли.
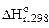 = 51,14 кДж;
= 51,14 кДж;
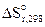 = - 4,67 Дж/К.
= - 4,67 Дж/К.
| РЕШЕНИЕ: |
NH4 NO3 + H2O <=> NH4OH + HNO3
 NH 4OH + HNO3
NH 4OH + HNO3
|
NH4 + + H OH <=> NH4OH +, pH<7, среда


 кислая
кислая
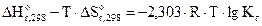 (8.1)
(8.1)
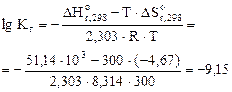
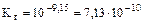 ,
,
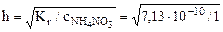 =2,67·10-5
=2,67·10-5
Т.к. среда кислая, то определяем рН:



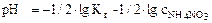 ,
,
рН = -1/2∙(-9,15)-1/2∙lg1= 4,60.
Ответ: 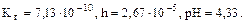
3. Что произойдет при сливании растворов хлорида железа (II) (FeCl2) и карбоната натрия (Na2CO3)? Написать уравнения реакций в ионно-молекулярной и молекулярной формах.

| РЕШЕНИЕ: До сливания в растворе каждой соли протекает ее гидролиз по I ступени (гидролизу подвергаются ионы Fe2+ и CO 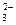 ): Fe Cl2 Fe (OH)2 + HCl слаб. сильн. Na2 CO3 NaOH + H2 CO 3 сильн. слаб. ): Fe Cl2 Fe (OH)2 + HCl слаб. сильн. Na2 CO3 NaOH + H2 CO 3 сильн. слаб. |
|
Fe2+ +HOH <=> FeOH+ + → Н2О
CO32-+ HOH <=> HCO3-+
После сливания растворов продукт гидролиза первой соли (Н+) взаимодействует с продукт  ом гидролиза второй соли (ОН-) с образованием слабодиссоциирующего соединения Н2О, что приводит к смещению химического равновесия в сторону прямых реакций. Усиление гидролиза первой и второй соли приводит к протеканию второй ступени гидролиза с образованием осадка и выделением газа, т.е. гидролиз протекает необратимо, до конца.
ом гидролиза второй соли (ОН-) с образованием слабодиссоциирующего соединения Н2О, что приводит к смещению химического равновесия в сторону прямых реакций. Усиление гидролиза первой и второй соли приводит к протеканию второй ступени гидролиза с образованием осадка и выделением газа, т.е. гидролиз протекает необратимо, до конца.
|
FeOH+ + HOH = Fe(OH)2↓ + + → Н2О
HCO3- + HOH = H2CO3 +

CO2↑ H2O
Сокращенное ионно-молекулярное уравнение гидролиза двух солей:
Fe2+ + CO32- + H2O = Fe(OH)2↓ + CO2↑.
Молекулярное уравнение совместного гидролиза:
FeCl2 + Na2CO3 + H2O = Fe(OH)2↓ + CO2↑ + 2NaCl
 2015-06-05
2015-06-05 2946
2946

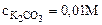 Kг -? h -? pH-?
Kг -? h -? pH-? 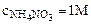 T=300K Kг-? h-? pH-?
T=300K Kг-? h-? pH-? 