На при кінці ХІХ ст. спектроскопистами був накопичений багатий дослідний матеріал по визначенню спектрів різний речовин, однак зі всією отриманою різноманітністю спектрів довго не вдавалося винайти які-небудь закономірності. Ретельне дослідження спектрів газоподібних речовині лужних елементів показує, що в них є визначені групи (серії) ліній, які описуються певним чином.
Вперше, в 1885 р., швейцарський фізик Бальмер Йоган Якоб (1825 – 1898) показав, що довжини хвиль однієї із серій спектра водню можна представити формулою:
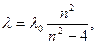 (1.1)
(1.1)
де l0=const (l0=3647 Å), n – ціле число, яке приймає значення ³ 3 ….
Це серія Бальмера, перша лінія серії (при n = 3) називається головною лінією.
Рідберг Йоган Роберт (1854 – 1919, шведский фізикспектроскопіст) запропонував більш зручний запис серіальних закономірностей в вигляді хвильових чисел:

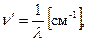 (число довжин хвиль в 1 см).
(число довжин хвиль в 1 см).
Тоді для серії Бальмера маємо:
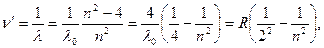 (1.2)
(1.2)
де R – постійна Рідберга (R = 109 677,6 см-1).
Серія Бальмера розташована в видимій у ближній УФ частині спектра, інтенсивність спектральних ліній спадає по мірі зростання хвильових чисел (до кінця спектра).
Пізніше були визначені і інші серії ліній у спектрі водню в ІЧ і УФ частинах спектра.
| УФ-серія Лаймана | 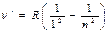 | n=2,3… | При n=2 lmax=1215 Å (резонансна лінія); при n=¥ lгр=911,27 Å (гранична лінія) | |
| Видима серія Бальмера | 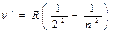 | n=3,4… | Ha=6563Å, Hb=4861Å, Hg=4340 Å, Hg=3971Å,Hгр=3647 Å | 1885 р. |
| ІЧ-серія Пашена | 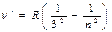 | n=4,5… | При n=¥ lгр=8201,4 Å (гранична лінія) | 1908 р.-передбачена Рітцем, винайдена Пашеном |
| Серія Бреккета | 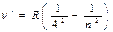 | n=5,6… | При n=¥ lгр=14 580 Å (гранична лінія) | Комбінація ліній серії Пашена |
| Серія Пфунда | 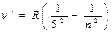 | n=6,7… | При n=¥ lгр=22 782 Å (гранична лінія) | Комбінація ліній серії Бреккета |
Як наслідок, відмічається чітка закономірність у розташуванні ліній водню, яку можна описати загальною формулою Бальмера
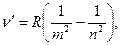 (1.3)
(1.3)
де m,n – цілі числа, n³(m+1).
Величина 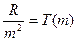 (спектральний терм) – хвильове число граничної лінії в даній спектральній серії (при n®¥), яка називається границею серії.
(спектральний терм) – хвильове число граничної лінії в даній спектральній серії (при n®¥), яка називається границею серії.
Якщо взяти ряд значень величин 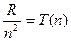 , то по (1.3) хвильові числа любих ліній спектра водню в серіях визначаються різницею:
, то по (1.3) хвильові числа любих ліній спектра водню в серіях визначаються різницею:
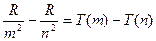 (1.4)
(1.4)
де T(m) і T(n) – спектральні терми, або просто терми. Це співвідношення представляє собою основний закон спектроскопії.
У 1908р. Рітц запропонував так званий комбінаційний принцип Рітца з якого витікають наступні співвідношення:
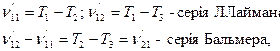
тобто різниця частот (хвильових чисел) однієї серії дає частоти (хвильові числа) іншої. При цьому треба враховувати наявність правил відбору.
2. Модель атома Томсона*.
Згідно класичних уявлень атом міг би випромінювати монохроматичну хвилю (спектральну лінію) тільки в тому випадку, коли електрон в атомі здійснює гармонічні коливання. Тобто утримується біля центра квазіпружною силою 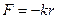 , де r – відхилення від положення рівноваги.
, де r – відхилення від положення рівноваги.
Дж. Томсон в 1903 р. запропонував наступну модель, яка відповідає вказаним уявленням: рівномірно заповнена додатним зарядом куля, всередині якої знаходяться електрони (атом в цілому електрично нейтральний).
 2015-06-28
2015-06-28 2951
2951







