Термодинамика необратимых процессов Онзагера имеет в своей основе весь аппарат классической термодинамики, включая первое и второе начала, а также два дополнительных принципа – линейности и взаимности [18, 19, 23, 44, 51, 60, 63]. Принцип линейности возник на основе обобщения известного уравнения (163), описывающего процесс распространения теплоты в анизотропном кристалле, на любые разнородные явления. Идея взаимности почерпнута из соотношений взаимности (163). Впервые предположение о существовании соотношений (164) высказал Стокс в 1851 г. В 1893 г. Соре и в 1903 г. Фойгт экспериментально подтвердили справедливость этих соотношений. Оба принципа объединены Онзагером в теореме взаимности, суть которой состоит в следующем.
Если потоки J и силы Y в линейных уравнениях переноса Онзагера
Ji = 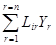 , (333)
, (333)
где i = 1, 2,..., n, выбираются из уравнения
Тs = JY вт/м3 (334)
Для скорости возникновения теплоты диссипации, то соблюдаются соотношения взаимности Онзагера
Lir = Lri. (335)
Для доказательства теоремы взаимности Онзагер воспользовался принципом микроскопической обратимости из теории детального равновесия химических реакций. Он распространил этот принцип на неравновесные системы, находящиеся вблизи состояния равновесия, и таким образом доказал справедливость соотношений (335). О принципе микроскопической обратимости уже говорилось достаточно. Из сказанного ясно, что термодинамика Онзагера, как и Клаузиуса, применима только для условий, близких к равновесным. Кроме того, только в этих условиях действует понятие энтропии, положенное в основу построения теории.
Таким образом, Онзагер впервые в широком плане ввел в макроскопическую теорию идеи переноса, а также положение о взаимном и симметричном влиянии потоков. На фоне идей равновесия и покоя классической термодинамики это явилось достижением исключительной принципиальной важности. Оно революционизировало теорию и стимулировало появление большого множества исследований в рассматриваемой области. За свою работу Онзагер в 1968 г. был удостоен Нобелевской премии. Эта награда подчеркивает важность для науки того факта, что теория, наконец, повернулась лицом к реальным необратимым процессам; она несомненно привлечет внимание инженеров и исследователей к идеям термодинамики, отличающимся фундаментальностью и неисчерпаемыми возможностями.
Легко убедиться в том, что термодинамика Онзагера вытекает из общей теории в качестве частного случая, ибо ее основные детали, включая термодинамику Клаузиуса и соотношения (333) – (335), содержатся в этой теории. При этом следует подчеркнуть, что в общем случае потоки J, силы Y и коэффициенты L у Онзагера не имеют точно того же смысла, как и в общей теории – формулы (190) и (191). Согласно теории Онзагера, потоки и силы выбираются из соотношения (334), которое должно быть установлено заранее из каких-либо соображений, выходящих за рамки теории. Если каким-то способом найдена скорость возникновения теплоты диссипации, то выражающая ее формула произвольно (формально) расчленяется на поток и силу. Однако трудность предварительного нахождения без знания закона диссипации, конкретного вида соотношения (334) и формальный характер выбранных потоков и сил ограничивают возможности теории Онзагера и часто приводят к неясностям [11, 14].
Химия.
При химических и фазовых превращениях происходит изменение массы веществ. Например, если в однородной смеси газообразных водорода и кислорода осуществляется реакция образования воды, то массы свободных водорода и кислорода уменьшаются, а масса воды возрастает. При этом перенос массы через контрольную поверхность системы приобретает известную условность. Эта условность относится как к самому процессу переноса, так и к способу выделения системы из окружающей среды.
Действительно, в данном случае уже нет герметически четко очерченной контрольной поверхности, через которую осуществлялся бы видимый перенос массы. Равномерно распределенные по объему молекулы водорода, кислорода и воды выделяются в особые подсистемы, между которыми и происходит обмен массой. Систему в целом обычно составляет вся совокупность молекул водорода, кислорода и воды. В рассматриваемом случае контрольная поверхность, разделяющая подсистемы, проводится мысленно и охватывает все однотипные молекулы системы. Молекулы водорода и кислорода, вступившие в реакцию, считаются выбывшими из соответствующих подсистем и поступившими в подсистему с молекулами воды.
Для большинства явлений перепад интенсиала в системе определяет степень ее неравновесности, а напор – интенсивность взаимодействия с окружающей средой. В случае химических и некоторых фазовых превращений напор интенсиала является одновременно перепадом. В этих условиях понятия неравновесности и нестационарности органически переплетаются между собой: нестационарная система одновременно является неравновесной, а стационарная – равновесной.
Статодинамический подход часто позволяет легко справиться с этой трудностью и рассматривать существенно неравновесную в целом химическую или фазовую систему как совокупность равновесных подсистем. Свойства любой статодинамической системы, в том числе химической, описываются рассмотренными выше простейшими дифференциальными уравнениями переноса. В тех случаях, когда каждая из подсистем не может рассматриваться как равновесная, приходится составлять весьма сложные кинетодинамические уравнения переноса типа (323) и т.д. В работах [11, 12, 14] приведены конкретные примеры различных реакций. В частности, подробно рассматривается тройная мономолекулярная реакция с учетом химической, термической, механической и других степеней свободы.
Из такой постановки вопроса, даваемой общей теорией, в качестве частного случая вытекает весь теоретический аппарат химии [14]. До появления термодинамики Онзагера химия располагала первым и вторым началами, уравнением Гиббса и принципом максимального значения энтропии в условиях равновесия химической реакции, которые заимствованы из классической термодинамики, а также принципом Ле Шателье, законом фаз Гиббса, законом Гесса, периодическим законом Менделеева, основным постулатом химической кинетики и т.д. Термодинамика Онзагера несколько раздвинула рамки теории – она позволила рассматривать химические реакции вблизи состояния равновесия. Однако при этом не были учтены все остальные степени свободы системы, кроме химической. В результате потоки оказались непропорциональными силам и т.д. [11, 12, 14]. Уравнения переноса химической массы, основанные на теории Онзагера, имеют вид формул (320) и (321), о чем уже упоминалось выше применительно к методам де Донде и Денбига. Общая теория позволяет изучать химические системы в любых условиях – равновесных и неравновесных, стационарных и нестационарных – с учетом взаимного влияния всех существенных для явления элат.
 2015-06-28
2015-06-28 3860
3860








