Классическая термодинамика была создана трудами Карно, Клаузиуса, Томсона (лорд Кельвин) и других ученых. Основные ее принципы – первое и второе начала – были сформулированы Клаузиусом в 1865 г. К ним иногда присоединяют третье начало – теорему Нернста о недостижимости абсолютного нуля температуры. Наконец, в самое последнее время (1956) Миллер [60] предложил назвать четвертым началом термодинамики теорему Онзагера, о которой говорится ниже.
Первым началом термодинамики служит найденный из опыта закон сохранения энергии для термической и механической элат:
dU = dQQ – pdV дж. (330)
Количество тепла dQQ Клаузиус расшифровал в виде формулы (197), которая была названа им уравнением второго начала термодинамики. С целью обоснования этого уравнения Клаузиус специально сформулировал следующий постулат, именуемый вторым началом термодинамики: теплота не может переходить сама собой от холодного тела к теплому. Постулат был применен Клаузиусом к равновесной (обратимой) системе. А.А. Гухман [22] впервые показал несостоятельность данного Клаузиусом «обоснования» уравнения (197). Он установил, что постулат Клаузиуса не находится в логической связи с полученным результатом и все «доказательство» Клаузиуса является кажущимся.
Как бы там ни было, основу классической термодинамики составляют уравнения (197) и (330), дополненные Гиббсом выражением для химической степени свободы – формула (20). Нетрудно убедиться в том, что классическая термодинамика с ее первым и вторым началами, а также третье и четвертое начала вытекают как частные случаи из общей теории. Например, уравнение (330) первого начала есть частное следствие общего уравнения (19), уравнение Гиббса – следствие выражения (20), энтропия – частный случай термиора и т.д.
В связи с этим целесообразно более подробно остановиться на сопоставлении свойств термиора и энтропии. Образно выражаясь, общая теория начинается там, где кончается энтропия и начинается термиор. При этом надо подчеркнуть, что во всех своих главных свойствах термиор принципиально отличается от энтропии, поэтому недопустимо смешивать две эти величины.
Понятие термиора было введено автором в 1950 г. в качестве основы первого варианта общей теории и опубликовано в работе [7]. Термиор существует реально. Он однозначно с качественной и количественной стороны характеризует элементарную термическую астату во всех ее проявлениях на любом уровне картины мироздания. Термиор, подобно всем экстенсорам, подчиняется закону сохранения. Закон сохранения термиора исключительно важен для понимания окружающего нас мира. Термиору присуща способность самопроизвольно распространяться в направлении убывания температуры. Перемещение термиора в этом направлении сопровождается выделением экранированного термиора диссипации, а в обратном – его экранированием (поглощением).
Термиор обладает квантовыми свойствами. Элементарным квантом термиора служит термиант t, величина которого определяется формулой (198). Наиболее характерно свойства термианта проявляются в фотоне. Термиант t представляет собой фундаментальную физическую постоянную. Согласно четвертому постулату, в природе должен существовать также антитермиант `t, который еще предстоит обнаружить экспериментально.
Энтропия S была введена в науку Клаузиусом в 1865 г. Энтропия представляет собой параметр состояния, характеризующий свойства макроскопической системы в условиях равновесия. Энтропия системы может изменяться, но переходить из тела в тело она не в состоянии. Переходит только теплота. Таким образом, энтропия приобретает смысл удобного расчетного параметра, который получается, если количество тепла разделить на температуру. За сто лет в энтропии невозможно было обнаружить другого физического смысла.
По Клаузиусу, реальный – необратимый – процесс теплообмена между двумя телами происходит следующим образом (рис. 10). Первое тело теряет количество тепла dQQ. Это тепло приобретает второе тело. Вследствие теплообмена энтропия первого тела уменьшается на величину
dS' = dQQ/T’ дж/град,
а энтропия второго тела возрастает на величину
dS” = dQQ/T” дж/град.
Знаменатель второй дроби T” меньше, чем знаменатель первой T’, поэтому суммарное изменение энтропии совокупности двух тел всегда больше нуля, т.е.
dS = dS” - dS’ = (dQQ/T”) – (dQQ/T’) > 0. (331)
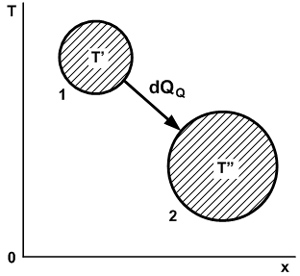 |
Рис. 10. Схема переноса теплоты от тела 1 к телу 2, по Клаузиусу.
Отсюда видно, что необратимые взаимодействия сопровождаются возрастанием энтропии. Но на сколько увеличивается энтропия, этого вопроса теория Клаузиуса решить не в состоянии. В результате количественная сторона всех реальных процессов оказалась за семью замками. Максимум, что можно было сделать для реальных процессов в рамках идеи о переносе теплоты, это написать следующее знаменитое соотношение:
dS ³ dQQ/T дж/град. (332)
Знак равенства относится к идеальным процессам, а знак неравенства – к реальным.
Понятие энтропии приводит к тем же результатам, которые дает термиор в идеальных условиях равновесия системы. Следовательно, энтропию можно рассматривать как частный случай термиора, относящийся к простейшим условиям равновесных состояний макроскопической системы. При такой постановке вопроса энтропия приобретает смысл макроскопического по размерам термиора, находящегося в состоянии покоя. Иными словами, энтропия – это огромное скопление покоящихся термиантов, которые вследствие их большого количества не проявляют своих зернистых свойств. В этом заключается единственно возможная правильная трактовка понятия энтропии. Разобраться в сути этого понятия оказалось возможным только благодаря общей теории, которая изучает термиату во всех ее проявлениях, частным случаем которых является покой, характеризуемый энтропией.
Разумеется, никто никогда не вкладывал в энтропию подобного смысла. Но такая точка зрения вполне законна, ибо энтропия на уровне макромира определяет термическую элату в состоянии покоя тела. Именно для этих целей она и была изобретена. Те же самые функции выполняет термиор, когда не перемещается, он тоже в одном из частных случаев характеризует термические свойства покоящегося макроскопического тела. Это сходство имеет принципиальное значение. Все остальное несущественно. В частности, несущественно, что Клаузиус наделил энтропию, например, способностью только возрастать в реальных процессах с трением и т.д. Много неясностей внес в энтропию сам способ ее вывода. Однако все это принимать во внимание не следует, ибо нельзя требовать от Клаузиуса, чтобы он на основе анализа частного понятия покоя сделал правильные выводы о более общем понятии движения. Всякая подобного рода экстраполяция свойств таит в себе неограниченные возможности односторонних оценок и заключений. Наоборот, перейти от более общего понятия к частному не составляет труда. При этом происходит как бы интерполяция свойств.
Под этим углом зрения становится ясным, что энтропию Клаузиуса нельзя отождествлять с функцией (энтропией) Больцмана, равной логарифму вероятности состояния механической системы, которая содержит большое число хаотически движущихся частиц. Энтропия Клаузиуса не имеет также смысла функции (энтропии) Шеннона, равной логарифму вероятности осуществления исхода некоторого опыта. В первом случае речь идет о кинетической элате, во втором – об информационной. Обе эти элаты ничего общего не имеют с термической, поэтому сходство между энтропией Клаузиуса и «энтропиями» Больцмана и Шеннона существует только на словесном уровне, т.е. на уровне неудачно присвоенных наименований.
 2015-06-28
2015-06-28 3038
3038
