Если в результате какой-либо мировой катастрофы все накопленные человечеством научные знания окажутся уничтоженными, а до будущих поколений дойдёт только одна фраза «все тела состоят из атомов», то с ней будет передана максимально возможная информация, ведь к пониманию этого человечество пришло только к концу 18 века. Сейчас мы называем это «атомной гипотезой», которая означает, что все вещества состоят из маленьких материальных частиц (атомов), которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, и отталкиваются, если одно из них плотнее прижать к другому. Известно три веществ: газообразное, текучее (жидкое) и кристаллическое (твердое).
Чтобы показать силу идеи атома, представим себе капельку воды размером 0,5 см. Если мы будем пристально разглядывать ее, то ничего, кроме воды, спокойной, сплошной воды, мы не увидим. Даже под лучшим оптическим микроскопом при 2000-кратном увеличении, когда капля примет размеры большой комнаты, и то мы все еще увидим относительно спокойную воду, разве что по ней начнут шнырять какие-то «футбольные мячи». Это парамеция — очень интересная штука. На этом вы можете задержаться и заняться парамецией, ее ресничками, смотреть, как она сжимается и разжимается, и на дальнейшее увеличение махнуть рукой (если только вам не захочется рассмотреть ее изнутри). Парамециями занимается биология, а мы прошествуем мимо них и, чтобы еще лучше разглядеть воду, увеличим ее опять в 2000 раз. Теперь капля вырастет до 20 км размера, и мы увидим, как в ней что-то кишит; теперь она уже не такая спокойная и сплошная, теперь она напоминает толпу на стадионе в день футбольного состязания с высоты птичьего полета. Что же это кишит? Чтобы рассмотреть получше, увеличим еще в 250 раз и нашему взору представится что-то похожее на фиг. 1.1.
|
|
|

Фиг. 1.1. Капля воды (увеличенная в миллиард раз).
Это капля воды, увеличенная в миллиард раз, но, конечно, картина эта условная. Прежде всего, частицы изображены здесь упрощенно, с резкими краями — это первая неточность. Для простоты они расположены на плоскости, на самом же деле они блуждают во всех трех измерениях — вторая неточность. На рисунке видны «кляксы» (или кружочки) двух сортов — черные (кислород) и белые (водород); видно, что к каждому кислороду пристроились два водорода. (Такая группа из атома кислорода и двух атомов водорода называется молекулой воды – H2O.) Наконец, третье упрощение заключается в том, что настоящие частицы в природе беспрерывно дрожат и подпрыгивают, крутясь и вертясь одна вокруг другой. Вы должны представить себе на картинке не покой, а движение. На рисунке нельзя также показать, как частицы «липнут друг к другу», притягиваются, пристают одна к одной и т. д. Можно сказать, что целые их группы чем-то «склеены». Однако ни одно из телец не способно протиснуться сквозь другое. Если вы попробуете насильно прижать одно к другому, они оттолкнутся.
|
|
|
Радиус атомов примерно равен 1 или 2 на 10-8 см. Величина 10-8 см это ангстрем, так что радиус атома равен 1 или 2 ангстремам (А°). А вот другой способ запомнить размер атома: если яблоко увеличить до размеров Земли, то атомы яблока сами станут размером с яблоко.
Представьте теперь себе эту каплю воды с ее частичками, которые приплясывают, играют в пятнашки и льнут одна к другой. Вода сохраняет свой объем и не распадается на части именно из-за взаимного притяжения молекул. Даже катясь по стеклу, капля не растекается, опять-таки из-за притяжения. И все жидкие вещества не улетучиваются по той же причине. Движение частиц в теле мы воспринимаем как теплоту; чем выше температура, тем сильнее движение. При нагреве воды толчея среди частиц усиливается, промежутки между ними растут, и наступает миг, когда притяжения между молекулами уже не хватает, чтобы удержать их вместе, вот тогда они и улетучиваются, удаляются друг от друга. Так получают водяной пар: при повышении температуры усиливается движение, и частицы испаряются.
На фиг. 1.2 показан пар. Рисунок этот плох в одном — при выбранном нами увеличении на комнату придется всего несколько молекул, поэтому сомнительно, чтобы целых 2,5 молекулы оказались на таком маленьком рисунке. На такой площадке скорее всего не окажется ни одной частицы. Но ведь надо что-то нарисовать, чтоб рисунок не был совсем пустым.

Фиг. 1.2. Пар под микроскопом
Глядя на пар, легче увидеть характерные черты молекул воды. Для простоты на рисунке угол между атомами водорода взят 120°. На самом же деле он равен 105°3', а промежуток между центрами атомов кислорода и водорода равен 0,957 А°. Как видите, мы довольно хорошо представляем себе эту молекулу.
Рассмотрим некоторые свойства водяного пара или других газов. Разрозненные молекулы пара то и дело ударяются о стенки сосуда. Под градом ударов стенки сосуда будут расходится, если их не придерживать. То есть, чтобы удержать газ в пределах сосуда к его стенкам нужно приложить давление. На фиг. 1.3 показан такой сосуд с газом (без него не обходится ни один учебник) — цилиндр с поршнем. Молекулы для простоты изображены теннисными мячиками, или точечками, потому что форма их не имеет значения. Они движутся беспорядочно и непрерывно.
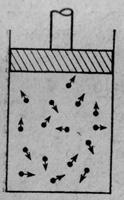
Фиг. 1.3. Цилиндр с поршнем
Множество молекул беспрерывно колотит о поршень. Их не прекращаемые удары вытолкнут поршень из цилиндра, если не приложить к нему некоторую силу (сила, собственно, — это давление, умноженное на площадь). Ясно, что сила пропорциональна площади поршня, потому что если увеличить его площадь, сохранив то же количество молекул в каждом кубическом сантиметре, то и число ударов о поршень возрастет во столько же раз, во сколько расширилась площадь.
А если в сосуде число молекул удвоится (и соответственно возрастет их плотность), а скорости их (и соответственно температура) останутся прежними? Тогда довольно точно удвоится и число ударов, а так как каждый из них столь же «энергичен», как и раньше, то выйдет, что давление пропорционально плотности. Если принять во внимание истинный характер сил взаимодействия атомов, то следует ожидать и небольшого спада давления из-за увеличения притяжения между атомами и легкого роста давления из-за увеличения доли общего объема, занятого самими атомами. И все же в хорошем приближении, когда атомов сравнительно немного (т. е. при невысоких давлениях), давление пропорционально плотности.
|
|
|
Легко понять и нечто другое. Если повысить температуру газа (скорость атомов), не меняя его плотности, что произойдет с давлением? Двигаясь быстрей, атомы начнут бить по поршню сильней; к тому же удары посыплются чаще — и давление возрастет. Вы видите, до чего просты идеи атомной теории.
А теперь рассмотрим другое явление. Пускай поршень медленно двинулся вперед, заставляя атомы тесниться в меньшем объеме. Что бывает, когда атом ударяет по ползущему поршню? Ясно, что после удара его скорость повышается. Можете это проверить, играя в пинг-понг: после удара ракеткой шарик отлетает от ракетки быстрей, чем подлетал к ней. (Частный пример: неподвижный атом после удара поршня приобретает скорость.) Стало быть, атомы, отлетев от поршня, становятся «горячее», чем были до толчка. Поэтому все атомы в сосуде наберут скорость. Это означает, что при медленном сжатии газа его температура растет. Когда медленно сжимаешь газ, его температура повышается, а когда медленно расширяешь, температура падает.
Вернемся к нашей капельке воды и посмотрим, что с ней будет, когда температура понизится. Положим, что толчея среди молекул воды постепенно утихает. Меж ними, как мы знаем, существуют силы притяжения; притянувшимся друг к другу молекулам уже нелегко покачиваться и прыгать. На фиг. 1.4 показано, что бывает при низких температурах; мы видим уже нечто новое. Образовался лед. Конечно, картинка эта опять условна — у льда не два измерения, как здесь изображено, но в общих чертах она справедлива.
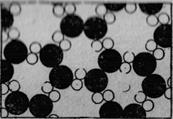
Фиг. 1.4. Молекулы льда
Интересно, что в этом веществе у каждого атома есть свое место, и если каким-то образом мы расставим атомы на одном конце капли каждый на свое место, то за многие километры от него на другом конце (в нашем увеличенном масштабе) из-за жесткой структуры атомных связей тоже возникнет определенная правильная расстановка. Поэтому если потянуть за один конец ледяного кристалла, то за ним, противясь разрыву, потянется и другой — в отличие от воды, в которой эта правильная расстановка разрушена интенсивными движениями атомов.
|
|
|
Разница между твердыми и жидкими телами состоит в том, что в твердых телах атомы расставлены в особом порядке, называемом кристаллической структурой. Даже в том случае, когда атомы находятся далеко друг от друга, ничего случайного в их размещении не наблюдается — положение атома на одном конце кристалла определяется положением атомов на другом конце, пусть между ними находятся хоть миллионы атомов. Это называется «дальний порядок». В жидкостях же, на дальних расстояниях, порядка в расположении атомов не существует. Поэтому говорят только о «ближнем порядке».
Расстановка молекул льда на фиг. 1.4 условная, но некоторые свойства льда здесь отражены верно, хотя в общем она неправильна. Верно, например, «схвачена» часть шестигранной симметрии кристаллов льда. Действительно: если повернуть картинку на 120°, получится то же самое расположение. Таким образом, лед имеет симметрию, вследствие которой снежинки все шестигранны. Из фиг. 1.4 можно также понять, отчего, растаяв, лед занимает меньший объем. Смотрите, как много «пустот» на рисунке; у настоящего льда их тоже много.
Но хотя лед обладает «жесткой» кристаллической структурой, его температура может тоже меняться, в нем есть запас тепла. Этот запас можно менять по своему желанию. Что же это за тепло? Атомы льда все равно не находятся в покое. Они дрожат и колеблются. Даже когда существует определенный порядок в кристалле (структура), все атомы все же колеблются «на одном месте». С повышением температуры размах их колебаний все растет, пока они не стронутся с места. Это называется плавлением. Наоборот, с падением температуры колебания все замирают, пока при абсолютном нуле температуры они не станут наименьшими из возможных (хотя полной остановки не наступит).
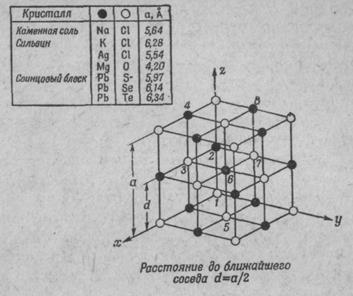
Соль — также твердое тело, кристалл, в котором «атомы соли» (NaCl) расставлены правильными рядами. На фиг. 1.5 показано трехмерное строение обычной соли (хлористого натрия).
 2015-06-24
2015-06-24 1792
1792








