Строго говоря, кристалл состоит не из атомов, а из ионов. Ионы — это атомы с излишком или с нехваткой электронов. В кристалле соли мы находим ионы хлора (атомы хлора с лишним электроном) и ионы натрия (атомы натрия, лишенные одного электрона). Ионы в твердой соли скреплены друг с другом электрическим притяжением, но в воде некоторые из них, притянувшись к положительному водороду или отрицательному кислороду, начинают свободно двигаться. При растворении в воде часть атомов Na и Cl уходит из кристалла, часть присоединяется к нему. Процесс этот динамический, подобный испарению; все зависит от того, много или мало соли в воде, в какую сторону нарушено равновесие. Под равновесным понимается такое состояние, когда количество уходящих атомов равно количеству приходящих. Если в воде почти нет соли, то больше атомов уходит в воду, чем возвращается из воды: соль растворяется. Если же «атомов соли» слишком много, то приход превышает уход, и соль выпадает в кристаллы. А это значит, что понятие молекулы вещества не совсем точно и имеет смысл только для некоторых видов веществ. Оно применимо к воде, в ней действительно три атома всегда скреплены между собой, но оно не очень подходит к кристаллу хлористого натрия.
Хлористый натрий - это ионы хлора и натрия, образующие кубическую структуру. Другие кристаллические вещества образуют иные структуры, которые позволяют классифицировать их по геометрическим признакам кристаллической решетки. Кубическая решетка среди них самая простая.
Но классификацию кристаллов можно провести не только по геометрическим признакам, но и по физической природе сил, удерживающих атомы в узлах кристаллической решетки, т. е. по видам химической связи между атомами.
§ 3.1.Виды химической связи между атомами в кристаллах
Между атомами в общем случае могут действовать гравитационные, магнитные и электрические силы. Однако гравитационное и магнитное: взаимодействия между атомами весьма малы. Так, потенциальная энергия гравитационного взаимодействия двух наиболее тяжелых атомов с атомным весом 250, расположенных на расстоянии 0,3 нм, равна 2,4·10-32 эв. Энергия магнитного взаимодействия двух элементарных магнитных диполей, находящихся также на расстоянии 0,3 нм, равна 7·10-6 эв (в приложении дать расчёт ????). Эта энергия значительно больше гравитационной, но и она много меньше средней энергии связи атомов в кристаллах, наблюдаемой экспериментально. Электростатическая энергия взаимодействия двух элементарных электрических зарядов, находящихся на расстоянии 0,3 нм, равна 5 эв (в приложении дать расчёт ????), что по порядку величины соответствует энергии химической связи, т. е. энергии связи валентных электронов в атомах. Следовательно, основную роль в образовании межатомных химических связей в кристаллах играют электрические силы, обусловленные валентными электронами.
По физической природе электрических сил, образующих кристаллическую структуру, различают четыре вида кристаллических решеток и соответственно четыре вида химических связей: ионная, ковалентная, металлическая и молекулярная. Такая классификация кристаллов в отличие от классификации по геометрическим признакам позволяет сделать некоторые выводы об их свойствах.
Рассмотрим основные свойства химических связей.
Ионная связь
Ионный вид связи в большинстве случаев образуется в результате соединения металлов с металлоидами (NaCl, KCl, СuСl2, CsCl и др.). В качестве примера ионного кристалла рассмотрим NaCl. Натрий имеет на один валентный электрон больше, чем у инертного газа неона. У хлора в свою очередь на валентной орбите не хватает одного электрона по сравнению с инертным газом аргоном. Известно, что атомы инертных газов имеют наиболее устойчивые орбиты, то придает им химическую стойкость. При образовании NaCl атом натрия отдает единственный валентный электрон хлору, в результате чего оба атома приобретают устойчивые внешние электронные оболочки и становятся соответственно положительным и отрицательным ионами. Равновесное состояние решетки такого ионного кристалла обеспечивается уравниванием кулоновской силы притяжения разноименных ионов силой отталкивания внутренних электронных оболочек, что соответствует минимальной потенциальной энергии системы.
Рассчитаем ориентировочно энергию ионной связи применительно к NaCl. Образование положительного иона натрия требует затраты энергии ионизации атома натрия, равной 5,1 эв. Образование отрицательного иона хлора сопровождается выигрышем энергии сродства атома хлора к электрону 3,7 эв. В целом процесс образования ионов требует затраты энергии, равной 1,4 эв. При электростатическом притяжении ионов выделяется значительное количество энергии, определяемое кулоновским взаимодействием. Электростатическая энергия ионов в молекуле NaCl, расположенных на расстоянии 0,25 нм (по спектроскопическим экспериментальным данным), равна 5,7 эв. Следовательно, энергия образования ионной молекулы NaCl из нейтральных атомов равна 4,3 эв. Из приведенного расчета можно сделать важный вывод о том, что для ионных кристаллов характерна значительная величина энергии связи. Этим объясняются высокие прочность и температура плавления ионных соединений.
Многие ионные кристаллы прозрачны, диамагнитны и являются изоляторами. При высоких температурах с увеличением подвижности атомов возникает электропроводность ионного типа, сопровождающаяся переносом отдельных ионов в кристалле под действием электрического поля.
Каждый вид химической связи может быть охарактеризован степенью насыщения связи. Ионная связь является ненасыщенной, т. е. каждый ион стремится сблизиться с максимальным числом противоположно заряженных ионов.
Ковалентная связь
Рассмотрим упрощенную картину образования ковалентной связи на примере молекулы водорода. В изолированном атоме водорода центр тяжести отрицательного заряда, образуемого вращающимся вокруг ядра электроном, находится в центре атома и совпадает с центром тяжести ядра.

Рис. 1.6.
При сближении атома водорода со вторым подобным атомом положение существенно изменяется. Наличие второго атома нарушает равномерное вращение электрона и создает возмущение его движения.
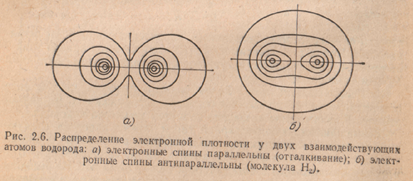
Рис. 1.7.
При этих условиях уже нельзя считать, что один электрон вращается вокруг одного из ядер, а второй — вокруг другого. На определенном участке пути «чужое» ядро будет влиять на электрон сильнее, чем «собственное», в результате чего электрон начнет вращаться вокруг второго ядра. Далее наступит момент, когда преобладающими вновь станут силы собственного ядра и электрон начнет вращаться вокруг него. Такое явление будет, иметь место для каждого; из двух электронов, причем описанная картина усложняется тем, что между самими электронами будут действовать силы взаимного отталкивания.
Из сказанного ясно, что при переходе от изолированных атомов к молекуле каждый электрон перестает принадлежать определенному ядру, а обобществляется, совершая симметричные движения относительно обоих ядер. Характер его движения становится, значительно более сложным, чем для изолированного атома. Таким образом, в процессе образования молекулы, атомы как система, состоящая из ядра и электрона, перестают существовать. Электроны, которые принадлежали определенным атомам, теперь связаны с обоими ядрами. Молекула водорода уже не представляет собой простую совокупность двух атомов водорода, а является совершенно новой системой. При установлении ковалентной связи выделяется определенное количество энергии, равное энергии взаимодействия между атомами в системе.
Рассмотренный механизм образования ковалентной связи является весьма упрощенным. Более глубокой причиной возникновения ковалентной связи является обменное взаимодействие. Обменное взаимодействие проявляется в процессе обмена электронами между атомами и имеет квантовомеханическую природу. Силы обменного взаимодействия называются обменными силами, а их энергия - обменной энергией. Признаком появления обменного взаимодействия является перекрытие электронных оболочек взаимодействующих атомов. В зависимости от ориентации спинов обобществляющихся электронов обменное взаимодействие проявляется в возникновении сил притяжения или отталкивания между сближающимися атомами. При антипараллельной ориентации спинов между атомами возникает сила притяжения, а при параллельной ориентации — сила отталкивания. Следовательно, молекула с ковалентной связью может быть образована лишь из атомов с противоположным направлением спинов валентных электронов.
Ковалентная связь имеет направленный характер: она образуется в том направлении, в котором расположена наибольшая часть электронного облака коллективизированных электронов.
Аналогичный по характеру механизм взаимодействия наблюдается не только у атомов водорода, но и у более сложных элементов, кристаллизующихся в решетке типа алмаза. При этом внутренние электроны остаются связанными с соответствующими ядрами и в образовании ковалентной связи практически не принимают участия. В случае германия и кремния каждый атом с помощью своих валентных электронов участвует в обменном взаимодействии с четырьмя ближайшими соседями по решетке. Каждый атом при этом находится в центре тетраэдра, образованного ближайшими соседями. На рис. 1.8 условно показана ковалентная связь в моноатомных полупроводниковых кристаллах. Каждые два соседних атома имеют два общих электрона, вращающихся вокруг обоих ядер.
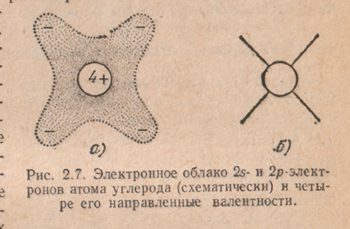
Рис. 1.8.
Образование ковалентной связи сопровождается перераспределением электронной плотности. Электронная плотность значительно возрастает между ядрами. Характерной особенностью ковалентной связи является ее насыщенность. Число связей, которое может быть получено в молекуле, ограничено и определяется валентностью.
В металлах в отличие от веществ с ионными и ковалентными связями валентные электроны не локализованы у соседних атомов, а принадлежат всему кристаллу. Поэтому при качественном описаний металлической связи употребляются термины: «электронное облако», «электронный газ» или «электронная жидкость».
Металлическая связь, характерная для большинства металлов, представляет собой взаимодействие совокупности положительных ионов, погруженных в электронную «жидкость», состоящую из коллективизированных валентных электронов. Находящиеся между ядрами электроны притягивают их друг к другу. Наличие в металле валентных коллективизированных электронов, с одной стороны, обусловливает хорошую электропроводность металлов, а с другой — приводит к образованию металлической связи между ядрами. Металлическая связь обычно образуется в тех случаях, когда число валентных электронов мало. Чем меньше число валентных электронов, тем слабее они связаны с ядром. В этом случае энергетически выгодно образование металлической, а не какой-либо другой связи. С увеличением числа валентных электронов условия коллективизации ухудшаются, и связь перерастает в ковалентную. Металлическая связь является ненасыщенной. Здесь отсутствует ограничение в отношении числа атомов, которые могут быть объединены между собой коллективизированными электронами.
Описанные типы химической связи являются предельными случаями химического взаимодействия между атомами. В действительности, возможно большее число переходных, промежуточных и смешанных типов связи в зависимости от природы и различия электроотрицательности реагирующих атомов. Так, например, предполагается, что в бинарных полупроводниковых соединениях, кристаллизующихся в решетке типа цинковой обманки, возникает смешанная ковалентно-ионная связь.
Молекулярная связь
Помимо описанных сил химической связи, в кристаллах существует молекулярная связь. Молекулы многих веществ представляют собой электрические диполи и называются поэтому полярными молекулами. В природе имеется также много веществ, молекулы которых являются неполярными, но под воздействием электрического поля, например, поля полярной молекулы, у них возникает индуцированный электрический момент. Поляризуемость неполярных молекул многих веществ очень велика. Электрический диполь может образоваться не только у молекул, но и у атомов, у которых могут возникнуть мгновенные дипольные моменты, притягивающие или отталкивающие их друг от друга в зависимости от мгновенных положений электронов на орбитах. Эти мгновенные моменты возникают на расстояниях, больших тех; при которых происходит перекрытие электронных облаков и при которых ковалентная связь еще не возникла. Два таких атома представляют собой динамическую систему, обладающую меньшей энергией в том случае, когда возникающие мгновенные дипольные моменты притягивают атомы друг к другу.
Силы взаимодействия между диполями полярных молекул, молекул или атомов с индуцированным электрическим моментом называются силами Ван-дер-Ваальса. Силы Ван-дер-Ваальса, действующие между молекулами и атомами, обычно малы. Поэтому энергия связи в молекулярных кристаллах очень мала. Молекулярная связь наблюдается у многих органических и неорганических химических соединений и обусловливает образование твердого состояния инертных газов, водорода, кислорода, азота. Поскольку силы молекулярной связи слабы, то твердые тела, имеющие этот вид связи, неустойчивы, легколетучи и имеют низкие температуры плавления.
 2015-06-24
2015-06-24 2314
2314
