Помимо сил химической связи, притягивающих атомы, между атомами действуют силы отталкивания, обусловленные взаимодействием внутренних электронных оболочек или ядер. Обе эти силы зависят от расстояния. Однако силы притяжения являются дальнодействующими и возрастают сравнительно медленно с уменьшением расстояния между атомами, в то время как силы отталкивания являются короткодействующими и очень резко возрастают при уменьшений расстояния.
Современная теория дает приближенную формулу для силы притяжения:
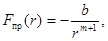
где b и m — постоянные, зависящие от вида химической связи. Так, например, в ионных кристаллах и в металлах m = 1, а в кристаллах с молекулярной связью m = 6. Силы притяжения и соответствующая им потенциальная энергия обычно записываются с отрицательным знаком.
Силы отталкивания выражаются сложной математической зависимостью от расстояния. В грубом приближении они могут быть описаны формулой
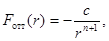
где с и n — постоянные, зависящие от природы атомов. Для некоторых кристаллов обычно полагают n = 12.
При определенном расстоянии, между атомами r == а эти силы уравновешивают друг друга, в результате чего атомы оказываются в равновесном состоянии.
Перейдем к рассмотрению энергии, обусловленной силами притяжения и отталкивания. Поскольку 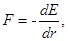 составляющие потенциальной энергии взаимодействия атомов будут иметь вид:
составляющие потенциальной энергии взаимодействия атомов будут иметь вид:
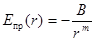
где В = b/m, С = c/n. Тогда результирующую потенциальную энергию запишем как
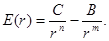
На рис. 1.9 показаны составляющие потенциальной энергии, а также-результирующая энергия Е взаимодействия атомов. Здесь энергия свободных атомов принята за нуль.
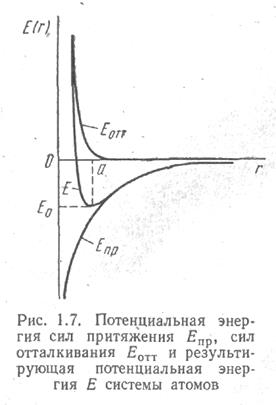
Рис. 1.9.
При повышении температуры интенсивность колебаний атомов вокруг устойчивого состояния увеличивается. При дальнейшем повышении температуры возможен случай, когда энергия теплового колебательного движения превысит энергию связи частиц Е0. В этом случае, очевидно, частица не возвратится в исходное состояние, и химическая связь будет разорвана.
Многие элементы и химические соединения в силу сложной структуры электронных оболочек и кристаллической решетки могут иметь, не один, а два и более минимумов энергии, причем последовательность этих; минимумов может располагаться не только в радиальных направлениях, но и по угловым координатам. Каждый минимум энергии соответствует определенному виду кристаллической решетки. В этом случае элемент или соединение кристаллизуется в такой решетке, которая соответствует наиболее глубокому минимуму энергии. При определённых температурных условиях может произойти перестройка кристаллической структуры, сопровождающаяся переходом в другой минимум потенциальной энергии. Способность к перестройке кристаллической решетки у некоторых веществ получила название полиморфизма. Наличие последовательности минимумов энергий в определенных предпочтительных направлениях свидетельствует об анизотропии сил межатомного взаимодействия. В результате такой перестройки возникают структурные модификации одного и того же, элемента или соединения. Примером таких модификаций является серое и белое олово, алмаз и графит.
§ 3.2. Классификация твердых тел по механизму электропроводности.
 2015-06-24
2015-06-24 2145
2145








