Растворимость углерода в железе, марганце, хроме достаточно велика, особенно в жидком состоянии, и может достигать 5 - 7 %. При получении металлов углетермическим восстановлением в металлах растворяется значительное количество углерода - они науглероживаются. Это объясняется не только благоприятными термодинамическими возможностями, но и созданием кинетических условий, способствующих растворению углерода в металле при его получении. В шахтных и ферросплавных печах струи жидкого металла стекая на подину печи, контактируют с кусками кокса и поглощают углерод, кроме того, идет насыщение металла углеродом при распаде оксида углерода, при контакте с углеродистой футеровкой печи. В ферромарганце концентрация углерода может достигать 7 %, в феррохроме - 8 %, в железе - 6,67 %.
Процессы науглероживания или обезуглероживания протекают и при нагреве металла в нагревательных термических печах при нагреве перед горячей деформацией металла.
Науглероживание газами
При нагреве стали в атмосфере, содержащей СО, происходит науглероживание поверхностного слоя металла. Процесс этот, иногда называемый цементацией, имеет большое значение для термообработки. Насыщение поверхностного слоя углеродом значительно повышает прочностные, режущие и другие механические свойства стали.
Реакция науглероживания может протекать по схеме I:
2СО↔[С] + СО2, ΔΗ<0 (145)
по схеме II с образованием устойчивого карбида:
3Fe + 2CO ↔ Fe3C + СO2, ΔΗ<0. (146)
По принципу Ле-Шателье повышение давления газовой фазы и понижение температуры будут способствовать науглероживанию, так как реакции (145) и (146) идут с выделением тепла ΔΗ< 0.
Для определения равновесного состояния в системе СО2 - Fe - С рассмотрим диаграмму состояния системы железо - углерод в той ее части, которая относится к процессам цементации: до 2 % углерода и при 500 - 1200 оС (рис. 50). При t > 720 °С на диаграмме имеются две двухфазные области: в одной из них (левой) в равновесии находятся аустенит А и феррит Ф (растворы углерода в α-Fe и γ-Fe), в другой области (правой) находятся в равновесии аустенит и цементит Fe3C. При, более низких температурах имеется двухфазная область: феррит + цементит. В соответствии с диаграммой в табл. 12 приведены возможные реакции цементации железа.
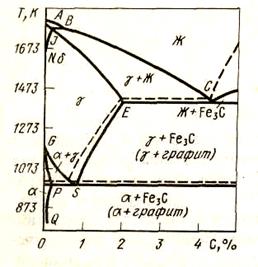 |
Рисунок 50 - Диаграмма состояния системы железо — углерод
Таблица 12 - Процессы цементации железа
| Тип взаимодействия | Число | ||
| Компонентов (К) | Фаз (Ф) | Степеней свободы (С) | |
| 1.СО +СО2↔А* | |||
| 2.СО +СО2↔А+Ф | |||
| 3.СО +СО2↔Ф**+Fe3C | |||
| 4.СО +СО2↔A+Fe3C | |||
| * А — аустенит, ** Ф — феррит. |
Все системы трехкомпонентны и состоят из углерода, железа и СO2. По правилу фаз С = К - Ф + 2 система 1 имеет 3 степени свободы: давление, температуру, концентрацию углерода в аустените. Системы 2, 3, 4 имеют по две степени свободы - температуру и давление.
Для всех указанных в табл. 12 взаимодействий значения константы равновесия должны быть одними и теми же:
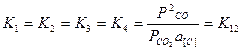 (реакции газификации углерода),
(реакции газификации углерода),
lgK12=-9000/T+9,28.
Известно, что активность углерода в Fe3C выше, чем в графите, т.е. 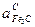
 > 1
> 1
По данным М.И.Темкина и Л.А.Шварцмана, активность углерода в железе зависит от его концентрации: если за стандартное состояние принять графит, для которого а C = 1
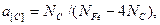
где NC и NFe - атомные доли С и Fe.
Разность NFe - NC связана с тем, что около атомов углерода в железе повышается электронная плотность и атомы углерода заполняют только 1/4 вакантных мест. За стандартное состояние принят разбавленный раствор углерода в γ-Fe.
Рассмотрим условия существования различных фаз в системе Fe - С и соотношение PCO/PCO2, которое принимаем за меру активности углерода при P = const (см. рис. 51) при различных температурах.
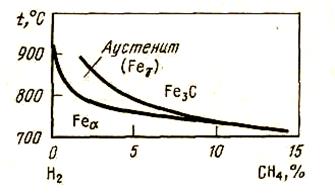 |
Рисунок 51 - Условия существования фаз в системе железо — углерод
1.Температура T1. В широком интервале концентраций углерода существуют две фазы: феррит и цементит. Для этой системы по правилу фаз: РCO/РCO2 = f (T) и при T = const РCO/РCO2 = const> что свидетельствует о постоянстве активности углерода независимо от соотношения количества фаз.
2.Температура T2. От 0 до концентрации C1 и от концентрации C2 и далее сохраняется постоянство активности углерода, различной в этих двухфазных областях. Поэтому в одной и в другой активности углерода не зависят от соотношения фаз. В интервале от ci до с2 в однофазной области РСО/РСО2 = f(T,NC) и при постоянной температуре РСО/РСО2 является функцией Nc, активность углерода возрастает с повышением концентрации углерода в аустените.
Следствием этого анализа является то, что для двухфазной области равновесный состав газовой фазы и активность углерода однозначно задаются температурой. В однофазной области активность углерода в железе определяется как температурой, так и соотношением Рсо/Рсо2*. Это верно при постоянном общем давлении.
Для давления 101,3 кПа диаграмма цементации железа оксидом углерода представлена на рис. 52. На этой диаграмме область существования двух твердых фаз превратилась в кривую, положение которой определяется изменением содержания углерода в насыщенном растворе под влиянием температуры. Так, кривая GS' соответствует равновесию: Ф + А ↔ СО - СО2,
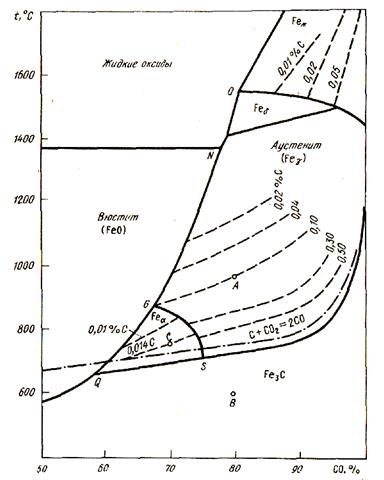
Рисунок 52 - Диаграмма равновесий науглероживания железа оксидом углерода (П)
кривая SE - равновесию Fe3C + А ↔СО - СО2 и кривая SQ - равновесию Ф + Fe3C ↔ СО - СO2. Каждая кривая отражает изменение состава газовой фазы под влиянием температуры для данной двухфазной твердой системы.
Между кривыми QN и QE находятся области однофазных систем. Между QG и QS - область феррита, между GN и SE - аустенит, выше линии ОР - углеродистый жидкий расплав. В каждой области имеется система линий для определения концентраций углерода, показывающих зависимость состава газовой фазы от температуры. Эти линии нанесены на диаграмме пунктирными линиями. Направление линий отражает вид зависимости РCO/РCO2 от T.
С ростом содержания углерода в растворе увеличивается и его активность а [С]. Кривые смещаются в сторону большего содержания СО в газовой фазе, вплоть до линии SE, соответствующей активности метастабильного Fe3C. Активность углерода в Fe3C (линия SE) будет больше активности графита в соответствии со штрихпунктирной линией.
С помощью данной диаграммы можно выбирать условия для науглероживания или обезуглероживания железа и состава конечного продукта при восстановительных процессах. Для науглероживания отношение РCO/РCO2 должно превышать равновесное для данной твердофазной системы (РCO/РCO2)равн. Для обезуглероживания значение РCO/РCO2 должно быть меньше. Любая точка на данной диаграмме задает условия процесса: температуру и РCO/РCO2, а также состав конденсированных фаз для этих условий.
Если, например, возьмем точку А, то, тем самым, определим состав газовой фазы и температуру для получения из вюстита аустенита данного состава (0,10 % С) или определим условия для обезуглероживания стали и чугуна, содержащих цементит, до такого же состава (0,10 % С). При понижении температуры данная точка может сместиться в положение В (температура 600 °С) - в область цементита, т.е. будет происходить предельное науглероживание. Если взять точку С, то она определит условия для обезуглероживания α-Fe, т.е. для получения железа с содержанием 0,014 % С. Для этого необходим нагрев до 750 °С при соотношениях РCO/РCO2, равных 2,3. Линия GN, разделяющая области вюстита и аустенита, показывает условия предельно низкого науглероживания железа и появления вюстита: Она соответствует двум одновременно протекающим реакциям:
3(FeO) + 3CO = 3Fe + 3CO2;
3Fe + 2CO = Fe3C + CO2,
суммарной реакцией будет реакция восстановления вюстита:
3(FeO) + 5CO = Fe3C + 4CO2.
При наличии в системе твердого углерода будет происходить регенерация образующейся С02 по реакции газификации углерода:
3Fe + 2CO = Fe3C + CO2,
СO2 + С = 2СО.
Суммарная реакция будет следующей:
3Fe + С = Fe3C.
Пределы науглероживания железа задаются штрихпунктирной кривой равновесия реакции газификации углерода.
Представляется удобным, как это было сделано С.И.Филипповым, для оценки взаимодействия углеродсодержащей атмосферы с металлом ввести понятие углеродного потенциала πC. Величина углеродного потенциала характеризует науглероживающую способность газовой фазы относительно металла. Углеродный потенциал есть химический потенциал углерода, сравниваемый со стандартным состоянием, для которого a C = 1.
πC = μC - μOC =ΔμC =RTln a C
где a C - активность углерода в металле, которую определяет газовая фаза; a C= PC/PCO где PCO - давление пара насыщенного атомного углерода над графитом, принимаемое за стандартное; PC - давление пара атомарного углерода над металлом, в котором' растворен углерод.
Углеродный потенциал газовой фазы связан с общим давлением. Чем выше давление, тем выше потенциал при неизменном соотношении PCO/PCO2. Как следствие возрастания углеродного потенциала является и увеличение науглероживания железа с ростом давления. Для достижения той же степени науглероживания, что и при более низком общем давлении, при повышении давления можно уменьшать отношение СО к СO2. Для интенсификации получения низкоуглеродистого металла применение вакуума может оказаться полезным. На диаграмме цементации при повышении» давления линия SE смещается влево к области вюстита, при этом область аустенита сужается, и при повышенных давлениях вюстит может непосредственно восстанавливаться до Fe3C с помощью газовой фазы.
В шахтных восстановительных печах (например, в доменной печи) обеспечиваются благоприятные условия для науглероживания железа.
По мере опускания твердые материалы попадают в газовую среду с более высокой температурой и одновременно с более высоким содержанием СО. Рост температуры повышает также и скорость процесса. Создаются благоприятные как термодинамические, так и кинетические условия науглероживания восстанавливаемого металла в твердом состоянии. Окончательное содержание углерода в продуктах плавки определяется условиями взаимодействия с жидкими фазами. Работа доменных печей на повышенном давлении газа под колошником способствует науглероживанию железа.
Потенциал углерода в карбидах меньше нуля πС < 0. В ряду Мо2С - Fe3C - Со3С - Ni3С углеродный потенциал возрастает при повышении активности углерода в этих карбидах. При увеличении сродства металла к углероду, т.е. уменьшении активности углерода в карбидах, должно понижаться содержание СО в газе для полнoго науглероживания металла.
Рассмотрим науглероживание железа углеводородсодержащим газом - метаном.
При распаде метана образуется углерод:
СН4 = С + 2Н2, ΔΗ>0, ΔΗ°298 =+17,89 кДж.
Распаду метана способствует повышение температуры и понижение давления. Зависимость изменения свободной энергии и константы равновесия от температуры выражается уравнениями:
ΔG° = 46240 - 29,96·T Дж; lgK = = -2418/T+1,41.
При распаде метана происходит науглероживание железа с образованием раствора: СН4 ↔ [C]Fe + 2Н2, ΔΗ > 0 и с образованием цементита: СН4 + 3Fe↔ Fe3C + 2Н2, ΔΗ<0.
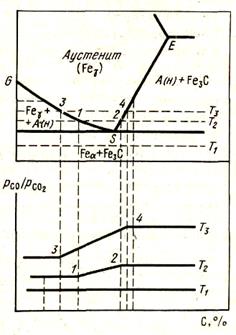 |
Рисунок 53 - Диаграмма науглероживания железа метаном
С.И.Филипповым построена равновесная диаграмма науглероживания железа метаном (рис. 53). С повышением температуры расширяется область науглероживания железа с образованием Fe3C так же, как с понижением давления. При понижении давления равновесные кривые будут смещаться влево, в сторону меньших концентраций СН4 в газовой фазе. По сравнению с диаграммой цементации железа СО здесь поля устойчивости аустенита сужаются. Метан является более активным науглероживателем, чем СО. При обогащении газа водородом будет происходить достаточно глубокое обезуглероживание железа без его окисления.
 2015-06-24
2015-06-24 4273
4273







