Механизм восстановления оксидов металлов газами
Основы современной теории восстановления были разработаны Г.И.Чуфаровым и его сотрудниками и получили название адсорбционно-каталитической теории восстановления. По этой теории процесс восстановления является топохимическим процессом, который протекает через разрушение старой кристаллической решетки и образование новой.
Реакция восстановления оксидов начинается на отдельных активных центрах на поверхности оксидов. На этих центрах происходит адсорбция молекул восстановителя. Возникновение трехмерных зародышей новой фазы - металла или низшего оксида протекает трудно, медленно - это так называемый инкубационный период.
По мере роста поверхности раздела между старой и новыми фазами процесс ускоряется - идет в автокаталитическом режиме. Катализатором в этом случае выступает образующийся продукт восстановления. Но при росте поверхности раздела отдельные участки образовавшейся новой фазы сливаются и скорость роста поверхности замедляется. Соответственно замедляется и ход процесса восстановления.
Первой стадией процесса восстановления является химическая адсорбция молекул восстановителя - газа на активных центрах поверхности оксида. При этом происходит деформация молекул газа-восстановителя вплоть до разрыва этих молекул на отдельные атомы. Деформированные молекулы или атомы обладают повышенной химической активностью. Эту стадию можно записать уравнением:
МеОт.+Вг=МеОт*Вадс.
Вторая стадия процесса - кристаллохимическое превращение, заключающееся в том, что атом кислорода отрывается из молекулы оксида и соединяется с атомом восстановителя с одновременной перестройкой решетки оксида металла в решетку металла или низшего оксида:
МеОт*Вадс = Мет*ВОадс..
Третья стадия заключается в десорбции молекулы оксида восстановителя в газовую фазу:
МетВОадс = Мет + ВОг.
Автокаталитический характер процесса проявляется в первую очередь образованием самой поверхности раздела между твердыми фазами металл - оксид, которая облегчает рост новой фазы. Она нарастает на уже появившейся решетке новой фазы. Особенно благоприятные условия создаются, если между решетками оксида и металла имеются ориентационно-размерные соответствия. Накладывает свое благоприятное, ускоряющее влияние и разупорядочи вание частиц межфазного слоя, появление асимметричного силового поля, способствующее бопьшей подвижности частиц и увеличению их реакционной способности. Кривая скорости процесса в зависимости от степени восстановления а на рис. 42 характеризуется наличием максимума скорости.
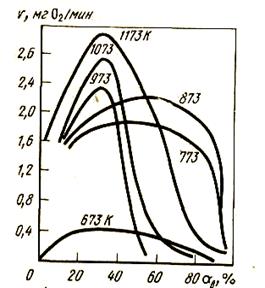 |
Рисунок 42 - Кинетика восстановления магнетита водородом
Типы взаимодействия восстановителя с оксидами
Различают два типа взаимодействия, которые отличаются друг от друга по соотношению скоростей диффузии металла и кислорода к поверхности оксида и скорости взаимодействия восстановителя с оксидом.
Поясним это положение. В процессе восстановления на поверхности оксида возникает слой восстановленного металла, обедненного кислородом, который был связан восстановителем и отведен в газовую фазу. Вследствие этого возникает градиент концентрации металла, направленный от поверхности в глубину слоя; градиент концентрации кислорода имеет обратное направление. Так как ионы металла, обладая меньшим радиусом, чем кислород, более подвижны, поэтому диффундируют быстрее, преимущественно с принадлежащими им электронами. Этому способствует то, что образующиеся фазы имеют катионные вакансии. Переход ионов через границы раздела твердых фаз сопровождается образованием пересыщенных растворов с последующей перестройкой кристаллических решеток. Имеет место реакционная диффузия, которая идет со скоростью νрд. Скорость же восстановления, т.е. скорость отнятия кислорода, обозначим νв.
Первый тип взаимодействия - ступенчатый. Этот тип взаимодействия характерен для высших оксидов, восстанавливаемых до низших.
Скорость диффузии превышает скорость восстановления: νрд > νв. На реакционной поверхности оксида идет медленное взаимодействие с восстановителем. Образующиеся при этом катионы металла с большой скоростью отводятся в глубь кристаллов оксида и не накапливаются на поверхности. Поэтому на поверхности оксида не происходит образования решетки нового низшего оксида. Эта новая фаза, т.е. "следующий" по степени уменьшения окисленности оксид, возникает лишь после того, как во всем объеме восстанавливаемого зерна оксида накопится такое количество катионов металла, которое приведет к образованию пересыщенного металлом раствора оксида, и только после этого во всем объеме происходит превращение в низший оксид. В заключение, до завершения одной ступени восстановления во всем объеме зерна оксида, другие процессы развития не получают. Таким образом, если взять оксиды железа, из зерна гематита сначала образуется магнетит, потом вюстит и только потом уже железо.
Второй тип восстановления - зональный, при котором νрд < νв. В этом случае на поверхности взаимодействия оксида с восстановителем скорость восстановления настолько велика, что путем диффузии не успевает отводиться в глубь старой фазы образующийся металл и на поверхности происходит накопление металла. Образуется пересыщенный раствор, возникает новая фаза - низший оксид. Появляется и граница раздела между старой и новой фазой. Затем аналогичное действие происходит и на поверхности новой фазы - образуется следующий низший оксид данного металла. И в заключение процесса на поверхности появляется слой восстановленного металла. Происходит пространственное разделение ступеней восстановления. Кусок гематита, восстановленный частично, будет состоять из четырех зон. Однако в ядре куска сохранится чистый гематит, а на поверхности будет слой железа, между ними будет располагаться слой магнетита, прилегающего к гематиту, и слой вюстита, прилегающий к железу. Это наблюдается при t > 570 oС. Возникающие три границы раздела в процессе восстановления будут перемещаться к центру куска до тех пор, пока он весь не превратится в кусок железа. Этот тип процесса является преобладающим при восстановлении кусковых материалов.
Процесс восстановления гематита начинается с химической адсорбции газа-восстановителя на поверхности α-Fe2O3 с образованием молекул СO2 или Н2O и их последующей десорбции. Возникают местные искажения исходной ромбоэдрической решетки, которая в тонком поверхностном слое перестраивается в решетку γ-Fe2O3 с катионными вакансиями. Дальше на поверхности накапливаются катионы Fe+2, которые диффундируют совместно с электронами в глубь гематита, заполняют вакансии в решетке γ-Fe2O3 и вызывают превращение ее в кубическую решетку магнетита: 4Fe2O3 + Fe = = 3Fe3O4, при этом часть катионов проникает в решетку Fe2O3 и перестраивает ее в переходную γ-фазу. Эта фаза сохраняется в виде промежуточного слоя между магнетитом и гематитом. В это же время образующиеся на поверхности катионы железа внедряются в слой магнетита и преобразуют его решетку в решетку вюстита с максимальной концентрацией кислорода Fe3O4 + Fe = 4FeO.
Далее постепенное насыщение вюстита железом приводит к снижению избыточной концентрации кислорода до минимума.
И на последней ступени восстановления вюстит на поверхности превращается в металлическое железо. Появление новых фаз сопровождается уменьшением мольных объемов твердых продуктов реакции. Для Fe2O3 он равен 21,8; Fe3O4 - 20,8; FeO - 16,6; Fe- 7,2см3/моль.
Эти соотношения указывают на возможность образования пористого слоя на поверхности восстанавливаемого оксида. При образовании пористых фаз видимые зоны в куске оксида отсутствуют. Зародыши новой фазы возникают на поверхности зерен оксида во всем объеме куска и зональность реализуется лишь в пределах отдельных микрокристаллов. Поэтому для пористых фаз мы наблюдаем лишь ступенчатую картину. Для плотных фаз ступенчатость и зональность наблюдаются взаимосвязано.
Механизм восстановления оксида железа водородом
В качестве оксида возьмем вюстит. При адсорбции молекул водорода на поверхности вюстита они отдают два электрона в слой вюстита, а молекула водорода диссоциирует на два - катиона Н+, которые взаимодействуют с анионами кислорода так, что происходит образование адсорбированной молекулы Н2O. Молекула воды удерживается на поверхности вюстита слабыми межмолекулярными силами и поэтому легко десорбируется и удаляется в атмосферу. Появление двух электронов вблизи катиона железа Fe+2 предопределяет возникновение атома железа. Возникновение множества атомов железа приводит к появлению решетки металлического железа. Из других мест на поверхности вюстита образующиеся атомы железа могут диффундировать по поверхности к местам, где уже образовалась металлическая фаза.
Таким образом картина восстановления будет записана следующими уравнениями:
Н2 = Н2адс=2Н+адс. + 2е;
Fe+2 + 2e = Feадс. =Feт;
2Н+адс.+О-2 = Н2Оадс = Н2О г;______
H2г + FeO = H2Oг + Fer
Реальность подобного механизма восстановления подтверждается тем, что при добавлении в газовую фазу даже малого количества водяного пара скорость восстановления резко падает. Это происходит потому, что молекулы водяного пара легче адсорбируются, чем молекулы водорода, благодаря большей поляризуемости и деформации молекул Н2О. Активные центры занимаются молекулами Н2О и для водорода не остается места для адсорбции. С повышением температуры тормозящее влияние Н2О ослабляется, так как адсорбция водяного пара происходит с большим выделением тепла, чем адсорбция водорода. Добавка Н2О особенно сильно влияет на начальный - инкубационный период процесса восстановления, который сильно затягивается. В дальнейшем при развитии процесса и образовании слоя продуктов восстановления с ограниченной газопроницаемостью наличие в газовой фазе Н2О уже мало влияет на скорость процесса, так как в толще продукта накапливаются значительные количества молекул Н2О, образующихся в результате восстановления, которые диффундируют уже от реакционной поверхности в газовую фазу, а не наоборот.
То же самое происходит и при восстановлении с помощью СО.
Скорость восстановления при добавках СО2 уменьшается. Особенно заметно это влияние проявляется при пониженных температурах, т.е. в области кинетического или смешанного режима. На рис. 43 показано, как замедляется восстановление магнетита водородом при добавлении к нему паров воды. Тормозящее влияние СО2 при восстановлении СО оказывается еще более сильным.
При сравнении восстановления оксидов железа водородом и оксидом углерода отмечено, что при обычных температурах восстановление водородом протекает более быстро, чем с помощью СО. Это объясняется как более высокой скоростью диффузии водорода в газовой фазе, так и лучшей адсорбируемостью молекул водорода по сравнению с молекулами СО.
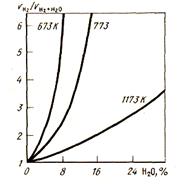 |
Рисунок 43 - Влияние содержания водяного пара в газовой фазе на отношение скоростей восстановления магнетита сухим и влажным водородом
Математическое описание восстановления оксидов
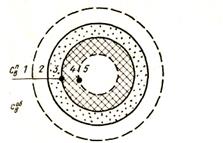
Для математического описания процесса восстановления выберем зональную модель восстановления куска оксида. На рис. 44 показана схема восстановления. Восстановительный процесс состоит из ] ряда последовательных и параллельных стадий.
 |
1. Подвод восстановителя из газового потока через газовый; диффузионный слой к внешней поверхности оксида.
Рисунок 44 - Схема восстановления куска оксида металла:
1 — газовый поток; 2 — диффузионный газовый слой; 3 — слой твердого продукта восстановления; 4 — реакционная зона; 5 – зерно оксида.
2. Диффузия газа-восстановителя через поры и трещины слоя
твердых продуктов реакции - металла или низшего оксида к границе
раздела твердого продукта восстановления с исходным оксидом.
3. Химическое взаимодействие восстановителя с оксидом, включая
адсорбцию молекул восстановителя, обмен электронами,
рождение и рост новой кристаллической фазы, образование оксидов
восстановителя, десорбцию молекул оксида восстановителя.
4. Диффузия ионов металла и кислорода и перенос электронов
через кристаллическую решетку продуктов восстановления и
первичного оксида.
5. Диффузия газообразных продуктов восстановления через
восстановленный слой к наружной поверхности по порам покровного
слоя и через тонкий газовый слой в ядро газового потока.
Отметим, что диффузионный перенос газа в объеме газа, т.е. стадия I, протекает с большой скоростью и не может являться тормозящим звеном процесса. Замедляющими весь процесс восстановления могут быть стадии внутренней диффузии или химического взаимодействия.
Скорость диффузии газа-восстановителя в порах равна:
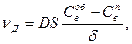 (132)
(132)
где D - коэффициент диффузии; S - площадь реакционной поверхности;
С об.в - концентрация восстановителя у внешней поверхности, равная концентрации восстановителя в объеме газа; С пв - концентрация восстановителя на границе раздела оксид - металл (низший оксид); δ - толщина слоя продуктов восстановления.
Примем для упрощения, что процесс восстановления описывается кинетическим уравнением реакции первого порядка
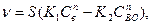 (133)
(133)
где K 1 и К 2 - константы скоростей прямой и обратной реакций; С пВО- концентрация оксида восстановителя - ВО на границе раздела МеО - Me (или низший оксид); С пв - концентрация восстановителя на этой же границе раздела, см. рис. 45.
Так как Робщ = Рпв + PпВО, то, разделив это уравнение на RT, получим, что С общ = С пВО + С пв, тогда, подставив в уравнение (133), исключим С пВО:
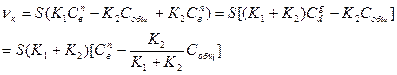 (134)
(134)
 |
Рисунок 45 - Распределение концентрации газа-восстановителя в порах и трещинах частично восстановленной пластины оксида (1,2 — слой продуктов реакции оксида соответственно)
В равновесии, когда скорости прямой и обратной реакций равны,
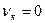 и
и 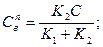 в этом случае
в этом случае 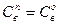 , где
, где 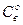 - равновесная
- равновесная
концентрация восстановителя, тогда:
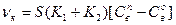 (135)
(135)
Обозначим К1 + К2 = К и получим:
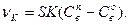 (136)
(136)
В стационарном режиме наблюдаемая (практическая) скорость восстановления νн равна скорости диффузии восстановителя к реакционной поверхности νд и скорости химического взаимодействия! νk. Приравняв полученные выражения
νн = νk + νд ,
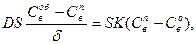
находим C пв и затем ν:
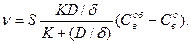 (137)
(137)
Это выражение отражает смешанный режим процесса, когда играют роль как диффузия восстановителя в порах, так и химическое взаимодействие.
В диффузионном режиме, когда К >> D /δ, получаем:

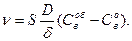 (138)
(138)
При увеличении толщины слоя продуктов реакции δ скорость восстановления уменьшается ν ~ 1/δ. Можно показать, что величина δ зависит
от 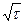 , что характерно для всех диффузионных режимов. Температура оказывает небольшое влияние на скорость диффузионного звена, так как зависимость коэффициента диффузии от температуры выражается уравнением D ~ kT 1,5-2, однако скорость химического взаимодействия имеет экспоненциальную зависимость от температуры:
, что характерно для всех диффузионных режимов. Температура оказывает небольшое влияние на скорость диффузионного звена, так как зависимость коэффициента диффузии от температуры выражается уравнением D ~ kT 1,5-2, однако скорость химического взаимодействия имеет экспоненциальную зависимость от температуры:
К = К o e -E/RT,
где Е - энергия активации, изменяющаяся в пределах 64 -100 кДж/моль. Поэтому при повышении температуры реакция восстановления переходит в диффузионный режим, т.е. диффузия газа в порах становится самой медленной стадией, начиная с некоторой толщины δ.
Давление не оказывает влияния на скорость процесса в диффузионном режиме, так как хотя с повышением давления коэффициент диффузии уменьшается, но одновременно возрастает концентрация частиц в газовой фазе.
В кинетическом режиме, когда К <<D/δ, получаем
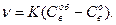 (139)
(139)
Толщина слоя продуктов реакции линейно растет со временем, но не влияет на скорость процесса. Давление сильно воздействует на скорость этого звена, поскольку
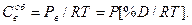 (140)
(140)
С повышением расхода восстановительного газа, обтекающего кусок оксида, восстановление ускоряется. Это связано с увеличением расхода газа на единицу объема оксида, при этом возрастает концентрация восстановительного газа вокруг куска оксида при одновременном уменьшении концентрации СO2 или Н2O. Тогда увеличивается разность концентраций газа-восстановителя снаружи и внутри куска, а также концентрация его оксида внутри и снаружи оксида. Это и вызывает рост скорости восстановления. В этом случае внешняя диффузия не лимитирует восстановление кусковых руд, скорость восстановления определяется процессами внутри кусков.
В начале восстановление контролируется скоростью процессов в реакционной зоне, определяемой пористой структурой оксида, Размерами и свойствами его внутренней поверхности, т.е. величинами D и К, входящими в уравнения (138) и (139). В результате процесса покровный слой продукта реакции утолщается. Время, необходимое для восстановления куска оксида, растет с увеличением его крупности.
С повышением температуры увеличиваются константа скорости К и коэффициенты внутренней диффузии D и наблюдаемая скорость восстановления. Начиная с некоторой температуры, различной для разных материалов, восстановление замедляется в связи с процессами рекристаллизации, спекания и размягчения твердых фаз, понижающими адсорбционно-химическую активность реакционной поверхности и ухудшающими пористую структуру покровного слоя и исходного оксида.
На практике процессы восстановления протекают значительно сложнее. Куски оксида, например, той же руды состоят из отдельных зерен, пронизанных порами и трещинами. Газ-восстановитель может диффундировать по этим порам в глубь куска, поэтому взаимодействие одновременно осуществляется во всем куске оксида - руды. Реакционная зона поэтому не локализуется в одном месте, а расширяется на много мест. Где больше газопроницаемость, там и полнее протекает восстановление. По данным, приведенным С.И.Попелем в книге "Теория металлургических процессов", при восстановлении железной руды уменьшение размеров кусков оксида железа сопровождается ускорением восстановления и сокращением времени его завершения. Например, при восстановлении магнетита водородом при 1320К в частицах размером 0,2 мм восстановление завершается 1 через 2 мин; при размере 1 мм - через 4 мин, при размере 3 мм - через 13 мин. Это согласуется с приведенными выше уравнениями, в которых скорость пропорциональна поверхности реакционной зоны. Чем мельче зерно оксида, тем больше суммарная поверхность кусков.
Влияние пористости на протекание процессов восстановления
Пористость продуктов восстановления является функцией температуры восстановления. С повышением t > 550 °С пористость заметно падает и при 800 - 900 °С становится настолько малой, что восстановление водородом значительно уменьшается.
Пористость железа (доля объема вещества, занятого порами), полученного в результате восстановления гематита и магнетита, достигает 0,2 - 0,3, причем большую часть пор на 65 - 90 % составляют очень мелкие поры величиной до 50 нм. При 570 - 770 К пористость имеет постоянную величину, но при более высоких температурах она сильно снижается из-за спекания мелких частиц железа, что связано c ростом скорости диффузии железа. И при 1130 К пористость оказывается в 15 раз меньшей, чем при 730 К. Уменьшение пористости приводит и к понижению скорости восстановления при высоких температурах. До 830 К скорость восстановления растет, а при дальнейшем нагреве до 1070 К падает.
Пористость связана и с природой оксидов. Так, пористость восста- новленного гематита больше пористости восстановленного магнетита. При температуре до 500 °С большую часть составляют поры с радиусом <5-10-5 нм.
На процесс восстановления оказывает большое влияние природа оксида - руды. Пористость наиболее плотных бурых железняков составляет 40 - 50 %, а неокисленных магнитных железняков -5 - 10 %. Размер куска железной руды также влияет на скорость восстановления. Увеличение размера кусков плотных руд с 10 до 30 мм вызывает понижение степени восстановления с 82 до 6 - 12 %. Размеры пор в агломерате изменяются в пределах от 4,5 * 10-10 до 3,5 * 10-6 м. Наиболее легковосстановимыми рудами являются бурые (Fe(OH)3) и шпатовые (FeCО3) железняки, а самыми трудновосстановимыми - магнетитовые и титаномагнетитовые руды. Шпатовые и бурые железняки при их нагреве выделяют водяной пар и СО2, становятся при этом пористыми.
В зависимости от строения, минералогического состава восстановление железных руд может развиваться по различным схемам (рис. 46). Если между кристаллами магнетита и гематита в руде
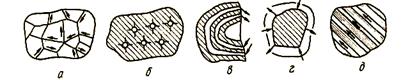
Рисунок 46 - Возможные схемы восстановления кусков руды
о - сетчатое восстановление; б — образование центров восстановления; в — восстановление по концентрическим участкам; г — фронтальное восстановление; д — полосчатое восстановление
находятся прослойки других веществ, то процесс может протекать по границам кристаллов (сетчатый процесс) (рис. 46, а).
Если при нагревании руда растрескивается, то восстановление протекает фронтально (рис. 46, г). Если в руде возникают чередующиеся концентрические поверхности раздела, то восстановление идет концентрически (рис. 46, в). В рудах с полосчатым строением, восстановление осуществляется слоями (рис. 46, д). При восстановлении агломератов одновременно образуется множество центров на периферии и внутри куска агломерата (рис. 46, б).
Растрескивание руд связано с тем, что один из минералов претерпевает в процессе нагрева превращение с изменением объема. Так, если в состав руд входит кварцит, то при 575 °С он переходит в α-фазу, при 875 оС - в тридимит и значительно меняет свой объем. При этом восстановимость руды возрастает. Но нужно учитывать, что растрескивание в целом ухудшает газопроницаемость рудного слоя, что затрудняет восстановление.
Наиболее плотными рудами являются магнетиты и титаномагнетиты, пористость которых в процессе нагрева и восстановления не увеличивается. Шлаки передельных производств восстанавливаются еще труднее, что обусловлено наличием в них значительных количеств файялита - силиката железа.
Общей характеристикой железорудных и других оксидных материалов является восстановимость материала, которая в основном зависит от степени доступности оксидов для восстановительных газов и состояния оксидов.
Механизм восстановления оксидов твердым углеродом
Уравнение МеО + С = Me + СО не отражает действительного механизма реакции, которая протекает через несколько ступеней с обязательным участием газов как промежуточных продуктов.
Действительная площадь контакта твердых фаз между собой составляет ничтожную долю общей поверхности, поэтому непосредственное взаимодействие оксида с твердым углеродом имеет второстепенное значение. Рассмотрим следующие возможные схемы этого процесса.
1. Двухступенчатая схема. Одновременно протекают реакции:
МеО + СО = Ме + СО2, (114)
С + СО2 = 2СО (12)
МеО + С = Ме + СО (117)
Здесь восстановление осуществляется газом - СО, а углерод лишь участвует в качестве восстановителя СО2. Этот процесс может протекать только тогда, когда обе реакции идут достаточно быстро. В первую очередь по этой схеме может происходить восстановление тех оксидов, которые успешно восстанавливаются только с помощью СО. Это прежде всего оксиды железа, никеля и других металлов с небольшим сродством к кислороду.
При восстановлении оксидов железа в атмосфере азота с увеличением скорости пропускания потока азота через систему скорость процесса восстановления падает, так как с азотом удаляются газообразные участники процесса восстановления: СО и СО2.
При увеличении давления в системе возрастают парциальные давления СО и СО2 и восстановление оксидов железа, марганца, хрома и других ускоряется.
Восстановление по этой схеме может успешно протекать и при отсутствии непосредственного контакта оксида с углеродом, в этом случае оно происходит только через газовую фазу.
2. Двухстадийная схема. По этому пути может идти восстановление оксидов, отличающихся высокой упругостью диссоциации, более 1 Па. Вначале происходит диссоциация оксида, а затем взаимодействие кислорода с углеродом:
МеО = Ме+1/2О2,
С + 1/2О2 = СО.
МеО + С = Me + СО
3. Схема с испарением оксида. В этой схеме подразумевается, что при температуре восстановления скорость испарения оксида будет большой и процесс будет идти путем испарения оксида и последующей его конденсацией на поверхности углерода с протеканием собственно реакции восстановления:
МеОт = МеОг,
МеОг + Ст = МеОадсСт,
МеОадсСт = МетСОадс,
МетСОадс = Мет + СОадс,
МеОт + Ст = Meт + СОГ
Таким путем может происходить восстановление летучих оксидов: МоО3, WО3, Nb2О5 и других при 630 - 870 К.
Предельная скорость восстановления определяется скоростью испарения оксида. По этой же схеме может происходить восстановление А12О3, MgO, Ta2О3, ZrО2, а также кремнезема, при нагревании которого образуется летучий оксид SiO.
4. Непосредственное взаимодействие твердых фаз. Хотя возможности контакта двух твердых фаз очень невелики, но все же в местах соприкосновения идет реакция прямого восстановления. В месте контакта образуется прослойка из восстановленного металла или низшего оксида, через которую идет диффузия реагентов. Эта схема реализуется при восстановлении Ag2О, CuO, Fe2О3 при 500 К. Очевидно, процесс этот реализуется путем поверхностной диффузии атомов металла и кислорода, которые перемещаются по поверхности углерода, достигают активных участков, где атомы углерода слабо удерживаются в решетке и вступают во взаимодействие. Атомы же металла внедряются в межбазисные объемы графита и тем самым ослабляют связи атомов углерода в решетке графита.
Рассмотрим восстановление по схеме 1. Лимитирующей стадией является обычно реакция взаимодействия углерода с СO2. Это подтверждается тем, что состав отходящего газа близок к равновесному составу реакции косвенного восстановления. В нем содержится больше СO2, чем в равновесном газе по реакции С + СO2 = 2СО (12). Поэтому можно заключить, что реакция (114) протекает быстрее реакции (12), поэтому скорость образования СO2 превышает скорость ее потребления по реакции (12).
Лимитирующий характер реакции (12) объясняется и тем, что все факторы, которые ускоряют взаимодействие СO2 с углеродом, как-то: использование более реакционноспособных сортов угля, увеличение содержания углерода (угля) в реакционной смеси измельчение угля, введение катализирующих добавок в уголь, повышают общую скорость восстановления. Например, добавки в уголь Na2CO3 и К2СO3 ускоряют восстановление Fe3O4 углем в 6 - 8 раз, а введение ферритов кобальта и никеля ускоряет процесс в 10 - 100 раз. На лимитирующую роль реакции (12) указывает и близость величин кажущихся энергий активации всего процесса прямого восстановления: 140 - 400 кДж/моль и 188 кДж/моль для реакции (12), в то время как энергия активации реакции (114) составляет 85 кДж/моль.
Но при использовании действий, устраняющих торможение процесса реакцией (12) (они перечислены выше), контроль может перейти и к реакции (114). То же наблюдается при развитии процесса восстановления, так как увеличивается сопротивление диффузии СО через слои продуктов восстановления, возникших на поверхности зерен оксидов, и реакция (114) замедляется. Сложный ход восстановления оксидов железа демонстрируется на рис. 47. Максимум скорости характерен для автокаталитического механизма реакции косвенного восстановления и показывает именно значение этой ступени в двухступенчатой схеме процесса. Минимум на кривой 1 восстановления Fe3O4 показывает, что весь магнетит восстановился до вюстита и дальнейшее восстановление идет только в случае появления новой фазы - кристаллов железа. Наступает новый индукционный период, который снижает общую скорость восстановления.
Попель С.И. приводит расчет скорости прямого восстановления, считая, что тормозящей является стадия газификации углерода:
скорость реакции (12) 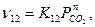 ,
,
где К12 = KOe-E/RT - константа скорости реакции (12); n - порядок реакции, равный 0,5 - 1.
Константа равновесия реакции (114) равна:
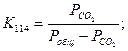
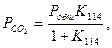
тогда
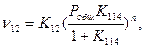
чем больше общее давление, тем выше скорость восстановления.
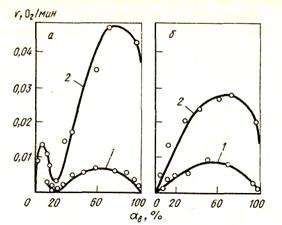 |
Рисунок 47 - Кинетика восстановления Fe3О4 (а) и FeO (б) углеродом при 1370 К в вакууме (1) и при накоплении газов (2)
Для непрочного оксида с большой упругостью диссоциации К114>> 1, т.е. РСО2 ≈ Р, следовательно, ν =KOPne-E/RT и энергия активации всего процесса восстановления равна энергии активации реакции (12).
Можно показать, что для прочных оксидов кажущаяся энергия активации будет больше, чем для первого случая. При росте упругости диссоциации оксида растет и скорость его прямого восстановления.
Рассмотрим восстановление оксида в потоке СО, когда слои оксида перемешиваются слоями угля.
В слое оксида происходит реакция косвенного восстановления:
МеО + СО = Ме + СO2.
Во втором слое происходит восстановление СO2 углеродом: СO2 + С = 2СО.
На первой стадии скорость взаимодействия равна: ν1 = K1PnCO, во втором слое скорость равна: νII = KIIPnCO2, где KI и КII - константы скоростей; n и m- порядок реакций.
При нагреве выше 900 °С равновесный состав газа близок к 100 % СО, весь СО2 в слое угля превращается в СО.
В зависимости от соотношения скоростей первого и второго этапов, возможны следующие случаи.
1. νII = νI. При этом КII > KI, так как PCO > РCO2- Весь СO2, образующийся в первом слое, исчезает во втором. При этом на каждый моль восстановленного металла расходуется один моль углерода. И суммарное превращение описывается уравнением прямого восстановления: МеО + С = Me + СО.
2. νII > νI. В этом случае КI > КII. Возникает больше СO2, чем то, которое может прореагировать с коксом. На каждый моль восстановленного металла расходуется меньше моля углерода и из реакционной зоны будет выходить смесь газов СО и СО2. Часть металла восстанавливается прямым восстановлением, а часть - косвенным. Суммарный процесс представляет собой смешанное восстановление: чем сильнее отличается ν от νII, тем меньше доля металла, получаемого восстановлением углеродом.
3. νII >> νI или KI>> КII. В этом случае реакция (12) не играет существенной роли, ею можно пренебречь, имеет место чисто косвенное восстановление. В отходящем газе соотношение СО2/СО будет более высоким, чем в случае 2.
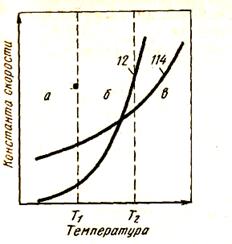
Соотношения скоростей и, следовательно, тип процесса восстановления во многом зависят от температуры. Энергия активации реакции (114) примерно равна 85 кДж/моль, а реакции (12) - 188 кДж/моль, поэтому К12 и v12 с ростом температуры растут быстрее, чем K114 и v114, что показано на рис. 48. Можно выделить три области реагирования:
а - при t < t1 область косвенного восстановления;
б - при t1 -t2 область смешанного восстановления;
в - при t > t2 область прямого восстановления.
 |
Для оксидов железа t1 = 800 - 850 °С, t2 = 1150 - 1250 oС. Несмотря на то, что термодинамически восстановление вюстита до металлического железа возможно лишь при нагреве выше 700 °С, на практике имеет место низкотемпературное косвенное восстановление оксидов железа до металла благодаря тому, что отдельные реакции не достигают равновесия.
Рисунок 48 - Зависимость константы скоростей реакций (12) и (114) от температуры
Рассмотрим восстановление достаточно прочных оксидов: МnО и SiO2 углеродом. Как видно из рис. 49, при восстановлении МnО скорость восстановления с ростом температуры растет. При измельчении оксида и углерода скорость восстановления также увеличивается. Продуктом восстановления закиси марганца углеродом является жидкий марганец, насыщенный углеродом, обволакивающий твердые частицы невосстановленного оксида и углерода.
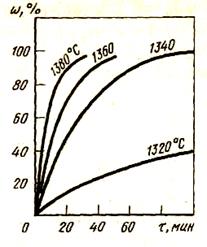 |
Рисунок 49 - Зависимость степени восстановления MnO графитом от времени
Суммарная реакция восстановления имеет вид:
МnOт + С = Мnж + СО (141)
Восстановление SiO2 протекает с образованием монооксида кремния. При температурах выше температуры плавления SiO последняя получается в жидком состоянии и выполняет роль посредника между зернами графита и кремнезема-кристобаллита.
На поверхности контакта протекает реакция:
x SiOж + Cгр= SixOx-lж + CO. (142)
Образующиеся ионы кремния и освободившиеся электроны диффундируют к поверхности кристобаллита, где и взаимодействуют по реакции:
SiО2T + Si+2 + 2e = 2SiO. (143)
Параллельно с этим процессом происходит возгонка монооксида кремния, которая взаимодействует с углеродом по объемной реакции:
SiOг + nС = nС·SiOадс;
nС·SiOадс= (n- 2)С + SiC + CO.
 2015-06-24
2015-06-24 4625
4625
