Глава III. Основы восстановительных процессов
В черной металлургии большинство металлов в природном состоянии находится в виде оксидов - это оксиды железа, марганца, хрома, кремния и другие. Для извлечения металла из руды в производстве осуществляют процесс восстановления. Процесс восстановления заключается в отнимании кислорода из молекулы оксида с помощью элемента-восстановителя, который имеет большее сродство к • кислороду, чем металл, который хотят получить. Так как оксиды большинства металлов обладают весьма низкой упругостью диссоциации даже при относительно высоких температурах, то получение их путем термического разложения оксидов практически невозможно. Процесс восстановления можно рассматривать и как окислительный в отношении восстановителя, так как, отнимая кислород из молекулы оксида металла, он сам - восстановитель - окисляется. Поэтому в общем эти процессы относят к окислительно-восстановительным.
Общая характеристика окислительно- восстановительных процессов
Окислительно-восстановительную реакцию в общем виде можно записать так:
МеОт + В = Ме + ВО, (111)
где Me -восстанавливаемый металл; В - восстановитель.
Для термодинамического анализа в соответствии со ступенчатой теорией А.А.Байкова можно представить реакцию восстановления как сумму двух реакций:
МеО = Ме+1/2О2, (112)
В+1/2О2=ВО____ (113)
МеО + В = ВО + Me
Эта схема не отражает истинного механизма процесса, отметим, что она удобна только для термодинамического анализа.
Суммирование термодинамических функций в соответствии законом Гесса позволяет получить следующие зависимости:
ΔНо111 ΔНо112+ ΔНо113; ΔGо111 = ΔGо112 + ΔGо113
lgK111 = (lgK112 + lgK113) = ½(lgPO2(MeO) – lg PO2(BO));
K111 = 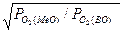
где Po2(MeO) и Po2(BO) - упругости диссоциации оксида металла и оксида восстановителя. Константа равновесия реакции восстановления зависит от соотношения упругостей диссоциации. Чем выше упругость диссоциации оксида, т.е. чем менее он прочен, тем больше величина константы равновесия и, следовательно, тем больше равновесие сдвинуто в правую сторону - в сторону более полного восстановления оксида. Чем прочнее оксид восстановителя, т.е. чем меньше его упругость диссоциации, тем больше равновесие смещено вправо.
В общем протекание реакции восстановления возможно в том случае, если изменение свободной энергии этой реакции меньше нуля, т.е. ΔGо111 < 0. Это осуществляется тогда, когда восстановитель обладает большим сродством к кислороду, т.е. ΔGо(MeO) > ΔGо(BO) или Po2(BO) < Po2(MeO). Чем больше разность между величинами Po2(MeO) и Po2(BO), тем больше константа равновесия реакции и тем полнее должно протекать восстановление.
Если восстановитель обладает меньшим сродством к кислороду, чем металл, т.е. ΔGо(MeO) < ΔGо(BO) и Po2(BO) > Po2(MeO), то pеакция должна протекать в направлении справа налево и вещество В будет восстанавливаться из своего оксида металлом Me. В данном случае восстановителем будет уже металл (Me). В том и другом случае реакция восстановления идет в сторону образования более прочного оксида.
Если же ΔGо112 = ΔGо113 и Po2(BO) = Po2(MeO) и ΔGо111= 0, то система находится в состоянии равновесия.
Приведенные рассуждения сделаны в предположении, что реагенты находятся в стандартном состоянии, когда же они находятся не в стандартном состоянии, то направление процесса также определяется соотношением между упругостями диссоциации оксидов при любом агрегатном состоянии вещества при наличии растворов и любой степени дисперсности. Восстановление всегда идет в сторону образования более прочного оксида и в качестве восстановителя по отношению к данному оксиду может быть взят любой элемент сродство у которого к кислороду выше, чем у рассматриваемого металла. Так в отношении оксидов железа восстановителями могут быть С, Si, Mn, A1, Mg, Ca и другие.
А.А.Байков следующим образом классифицирует оксиды по их восстановимости.
1. Легковосстановимые: Cu2О, NiO, CoO, Fe2О3, Мn2O3, МnO2. Они
обладают более высокими значениями PO2, чем FeO.
2. Равнопрочные с FeO: Fe3O4, Mn3O4, WO2, МоO2.
3. Трудновосстановимые: MnO, SiO2, A12O3, ТiO2, СаО. Прочность
этих оксидов значительно превышает прочность FeO.
В качестве восстановителей кроме металлов могут использоваться также и газы СО, Н2, СН4.
В металлургии одним из наиболее распространенных и дешевых восстановителей является углерод, используемый в виде угля или кокса. Такие процессы восстановления называются углетермическими или карботермическими. При высоких температурах в окислительной атмосфере углерод образует два оксида СО и СO2, из которых СО, обладая повышенным сродством к кислороду, является отличным восстановителем. Принято называть процесс с участием СО по реакции МеО + СО = Me + CO2 процессом косвенного восстановления, а процесс с непосредственным участием твердого углерода: МеО + С = СО + Me - процессом прямого восстановления.
Восстановление оксидов с помощью металлов называют металла-термическим восстановлением. Если в качестве восстановителя используют кремний, то процесс называют силикотермическим, если алюминий -алюмотермическим.
Восстановление оксидов газами
В качестве газообразных восстановителей используют СО или Н2. Эти восстановительные газы получаются окислением углерода при повышенных температурах (СО) или путем конверсии природного газа (СО и Н2). Рассмотрим реакцию восстановления
МеО + СО = Ме + СO2. (114)
Эта реакция может быть получена суммированием следующих реакций:
_2СО + O2 = 2СO2 (2)
2Ме + 02 = 2МеО.__________ (66)
2(МеО + СО = Ме + СO2). (114')
Константа равновесия равна К114'= P2CO2/PCO = (%СO2)2/(%СО)2 при активностях Me и МеО, равных единице. По правилу фаз С = К - Ф + 1, если металл и оксид не образуют между собой растворов, равновесие этой реакции не зависит от давления, система состоит из трех фаз имеет одну степень свободы С = 3 - 3 + 1 = 1. Равновесный состав газа является функцией только температуры. Так как реакция протекает без изменения объема участвующих в ней веществ, то соотношение равновесных концентраций СО и СО2 зависит только от температуры.
Реакция восстановления оксидов СО может быть как экзотермической ΔН114 < 0, так и эндотермической ΔН114 > 0. Это зависит от теплового эффекта образования оксида металла. Если реакция экзотермическая, то с повышением температуры К114 убывает, если реакция эндотермическая, то с повышением температуры К114 растет. Направление процесса в заданных условиях определяется по уравнению изотермы Вант-Гоффа:
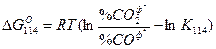
Если % СОФ2/% СОф < К114, то ΔG114 < 0 и реакция должна идти в прямом направлении. Если % % СОФ2/% СОф > К114, то ΔG114 > О и реакция протекает в обратном направлении. Это отчетливо показано на рис. 36.
Кривая соответствует равновесному состоянию системы Me - СО - СO2 - Me; газовые смеси в этом случае нейтральны по отношению к оксиду железа. Область выше кривой соответствует избытку СО по отношению к равновесному составу газа и в этом случае % СОФ2/% СОф < К114, газовые смеси будут восстановительными по отношению к оксиду и ΔG114< 0. Область ниже кривой соответствует составам газовых смесей, обогащенных СО, относительно равновесных составов, в этом случае % СОФ2/% СОф > К114 и ΔG114 > 0 - это окислительная область, восстановления оксида при этих условиях происходить не будет, это область устойчивого, существования оксида, в области газовых атмосфер над кривой устойчив металл.
С повышением прочности оксида константа равновесия реакции (114) при данной температуре уменьшается, кривая на графике рис. 36 должна перемещаться выше, наоборот при уменьшении прочности оксида перемещаться в нижнюю часть диаграммы. Так, для оксида МnО кривая расположена выше, чем для оксида FeO, а для
* Относится к заданным условиям.
NiO ниже, т.е. для восстановления МnО при тех же температурах требуется газовая фаза, содержащая более высокий процент восстановителя - СО, а для NiO - меньший процент СО.
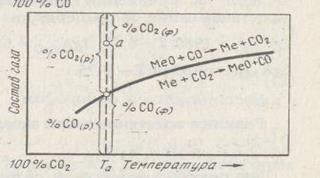 |
Рисунок 36 - Зависимость равновесного состава газовой смеси от температуры для реакции восстановления оксидом углерода (II)
В табл. 8 приведены константы равновесия реакций восстановления указанных оксидов и равновесный состав газа для них.
Как видно из таблицы, для легковосстановимых оксидов равновесный состав газа близок к 100 % СО2 и восстановление протекает даже при небольшой концентрации СО (см. табл. 8).
Восстановление закиси никеля протекает с выделением тепла, восстановление FeO - с небольшим выделением тепла, а восстановление МnО - с поглощением тепла.
Температурную зависимость константы равновесия K114 можно найити интегрированием уравнения изобары реакции (114). Если принять, что тепловой эффект реакции незначительно изменяется в данном интервале температур и его можно принять постоянным, то
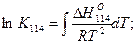
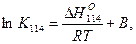
Таблица 8- Константы равновесия (К) и равновесные концентрации СО и СО2 в реакциях восстановления оксидов при 1000 К
| Оксид | К, при 1000 К | Равновесные концентрации,% | ΔНо1000, кДж | |
| СО | СО2 | |||
| NiO | 390,0 | 0,60 | 99,40 | - 48,0 |
| FeO | 0,61 | 61,50 | 38,50 | -19,9 |
| MnO | 8,1*10-7 | 99,99 | 7*10-5 | +103,5 |
| TiO2 | 2,1*10-10 | 99,999 | - |
где В равно ΔS/R. Угловой коэффициент этой прямой на графике в координатах lgК - 1/T равен ΔНO114/2,ЗR, а отрезок, отсекаемый на оси ординат, -ΔSO114/2,3R. Так, для оксидов, приведенных в табл. 8, уравнения зависимости константы равновесия реакции восстановления от температуры имеют вид:
lgKNiO = 1980/T+0,61; lgKFeO = 688/T- 0,9;
lgKMno = -5340/T – 0,75.
Восстановление водородом
Реакция восстановления водородом идет по уравнению:
МеО + Н2 = Me + НаО. (115)
Эта реакция может быть получена суммированием реакций:
Н2 + 1/2O2 = Н2O. (116)
—
Ме+1/2O2 = МеО. (112')
МеО + Н2 = Ме + Н2O
и константа равновесия реакции (115) равна
K115 = PH2O/PH2 = H2O%/H2%
Сравнивая реакцию (115) с реакцией (114), отметим, поскольку сродство СО и Н2 к кислороду одинаково при 1093 К, то и восстановительная способность этих газов при этой температуре одинакова. При температурах ниже 1093 К более сильным восстановителем является СО, так как он обладает более высоким сродством к кислороду, а при более высоких температурах лучшим восстановителем является водород.
Восстановление оксидов твердым углеродом
Взаимодействие кусков твердого углерода (уголь или кокс) с оксидами из-за несовершенства контактов между ними весьма ограничено. Восстановление оксидов твердым углеродом протекает обязательно с участием газовой фазы, состоящей из СО и СO2. Не рассматривая в данном случае механизм восстановления оксидов твердым углеродом, будем основываться на положении термодинамики, по которому определяющим для равновесия веществ является лишь начальное и конечное состояния.
Реакция восстановления оксидов углерода может быть получена суммированием следующих реакций:
Первый случай (I)
С + СO2 = 2СО. (12)
МеО + СО = Me + СO2 (114)
МеО + С = Ме + СО. (117)
Второй случай (II)
С + СO2 = 2СО (12)
2(МеО + СО = Ме + СO2) (114')
2МеО + С = 2Ме + СO2 (118)
Константа равновесия реакции (117) равна К117 = Pсо. Константа равновесия реакции (118) К118 = Рсо2, если считать, что активности MeO, Me и С равны 1.
Тепловые эффекты реакций ΔНo117 и ΔНo118 равны соответственно:
ΔНo117= ΔНo12 + ΔНo114; ΔНo118 = ΔНo12 + ΔНo114'
Большинство реакций прямого восстановления протекает с поглощением тепла.
Каждая система I и II состоит из трех компонентов (пять реагентов и два уравнения, связывающих их между собой) и четырех фаз: оксид, металл, углерод и газовая фаза, следовательно, по правилу фаз С = К-Ф + 2 = 3-4 + 2=1, системы одновариантны. Равновесие определяется температурой или общим давлением (Pсо + Pсо2). При постоянном давлении система (при наличии СО или СO2) может быть в равновесии только при определенной фиксированной температуре.
Поскольку реакция прямого восстановления является суммой двух реакций (12) и (114), то реакции газификации и реакции косвенного восстановления нанесем на одну диаграмму (рис. 37). Пересечение кривых в точке а показывает, что при постоянном давлении P совместное равновесие этих реакций возможно при единственной температуре Тр.
Рассмотрим условия восстановления при высоких и низких температурах:
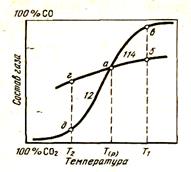 |
1. Температуры выше Тр - участок кривой правее точки а. Допустим, что реакция (114) косвенного восстановления находится в равновесии при температуре Т1} определяемой точкой б. Сравнение с состоянием равновесия реакции (12) при этой же температуре -точка в - показывает, что в системе содержится избыток СO2, и поэтому углерод, присутствующий в системе, должен окисляться, содержание СO2 в газовой фазе будет уменьшаться, а содержание СО - возрастать.
Рисунок 37 - Совмещение кривых равновесных составов газа для реакции косвенного восстановления (114) и реакции СО2 + С = 2СО(12)
Это будет нарушать равновесие реакции косвенного восстановления (114), которое будет смещаться вправо в сторону восстановления. Таким образом обе реакции будут идти вправо. При температурах выше Тр будет происходить восстановление оксида с участием твердого углерода. При избытке' твердого углерода в исходном состоянии оксид полностью восстановится, а какое-то количество углерода останется. При недостатке углерода произойдет частичное восстановление, углерод весь будет использован на восстановление, а какое-то количество оксида останется.
2. Температуры ниже Тр. Рассмотрим температуру Т2. При этой температуре состав газовой фазы, находящейся в равновесии с реакцией косвенного восстановления (114), точка г, будет отличаться от равновесного состава реакции газификации углерода - д. Газ будет обогащен СО и обеднен С02. Это вызовет распад оксида углерода. Равновесие реакции (12) сместится в левую сторону. Количество С02 в общей для обеих реакций газовой фазе увеличится, а СО - уменьшится, что вызовет смещение реакции косвенного восстановления также в левую сторону. И в результате будет происходить окисление металла и образование оксида. Таким образом, при температурах ниже Тр в присутствии твердого углерода оксид не восстанавливается.
Температура Тр называется температурой начала прямого восстановления в стандартных условиях. Она является функцией общего давления. Давление влияет на равновесие реакции газификации углерода, которая протекает с изменением объема. При уменьшении, давления равновесие реакции смещается в правую сторону, а кривая равновесия перемещается влево. При этом температура Тр падает. На этом механизме основаны процессы углетермического восстановления трудновосстановимых оксидов в вакууме.
Температуру начала восстановления твердым углеродом можно также найти с помощью графика рис. 38, на котором в координатах ΔG° - Т нанесены кривые зависимости ΔG° от Т для реакции окисления углерода (2С + О2 = 2СО) и реакций образования оксидов. Точка пересечения этих кривых означает, что ΔG°118 = 0, и температура, соответствующая этому пересечению, и будет температурой начала восстановления.
Если сравнить различные оксиды между собой, например NiO - Cr2O3 - SiO2, то оксиды менее прочные (NiO) имеют и более низкую температуру начала восстановления. При этом газовая фаза может содержать почти 100 % СO2, и суммарное прямое восстановление будет описываться реакций: 2МеО + С = 2Ме + СO2. уру начала восстановления. При этом газовая фаза может содержать почти 100 % СO2, и суммарное прямое восстановление будет описываться реакций: 2МеО + С = 2Ме + СO2.
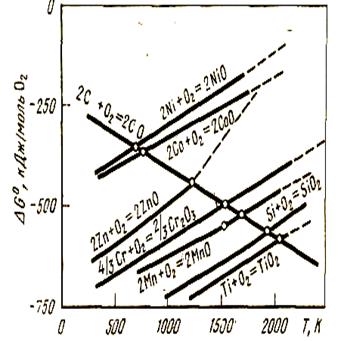 |
Рисунок 38 -Зависимость ΔG° от температуры для реакций образования оксидов и окисления углерода
Для закиси железа Тр равна 700 oС при P = 9,8 МПа. Для трудновосстановимых оксидов температуры начала восстановления превышают 1000 oС, при этом равновесный состав газовой фазы приближается к 100 % СО и суммарное превращение описывается реакцией: МеО + С = Me + СО.
Из приведенных рассуждений следует общий вывод, что углерод является универсальным восстановителем, который способен восстанавливать даже самые прочные оксиды. Важно только правильно определить температуру начала восстановления. Ниже приведены температуры начала восстановления некоторых оксидов углеродом в стандартных условиях
оксид.. FeО Cr203 MnO SiО2 ТiO2 MgO A1203 СаO Tp, K......973 1503 1693 1813 1973 2153 2323 2413
Восстановление оксидов металлами
Металлотермия - метод получения различных металлов и ферросплавов. В отличие от углетермии при этом способе восстановления получают безуглеродистые металлы. При использовании углерода в качестве восстановителя он частично растворяется в восстанавливаемом металле и с образованием карбидов, которые затем, если это необходимо, приходится удалять довольно сложным путем.
В общем виде реакция металлотермии представлена уравнением:
МеО + В = Ме + ВО,
где В - металл-восстановитель.
В зависимости от теплоты образования оксидов, участвующих в процессе, протекание реакции может происходить с выделением тепла или с поглощением. Если в течение процесса выделяется тепло, то можно не применять внешний подогрев системы. По правилу Жемчужного при восстановлении алюминием для осуществления восстановления должно выделяться тепла > 2300 кДж/кг шихты.
Алютермический способ применяют для производства феррованадия, ферротитана и других элементов.
Восстановление титана из ТiO2 протекает по реакции:
ТiO2 + 4/3Al = Ti + 2/3А12O3; ΔН°298 = -181000 кДж. (119)
Количество выделяющегося тепла q = 181000/115,9, где 115,9 -сумма молекулярных масс исходных веществ, взятых в стехиометри-ческих соотношениях; q = 1560 кДж/кг, это не удовлетворяет правилу Жемчужного. Поэтому получить алюмотермическим способом без внешнего подогрева чистый титан невозможно.
Для получения ферротитана алюмотермическим способом к ТiO2 добавляют Fe3O4 (~ 50 %). При этом происходит большое выделение тепла, достаточное для протекания процесса восстановления, однако получаемый сплав содержит только 20 - 25 % Ti, остальное - Fe.
При восстановлении оксидов кремнием - силикотермический процесс - количество выделяющегося тепла значительно меньше, чем при алюмотермии, поэтому восстановление кремнием проводят в дуговых ферросплавных печах с затратой электроэнергии на подогрев шихты.
С помощью силикотермии получают магний, кальций, металлический марганец, безуглеродистый феррохром, ферромолибден. Если в силикотермическом процессе получается газообразный элемент, например магний, по реакции
2MgO + Si = SiO2 + 2Mg,. (120)
давление пара магния достигает 133 Па при 1160 oС, а при 1716 °С 101,3 кПа, то, осуществляя процесс в вакууме, можно значительно понизить температуру восстановления. Для получения продуктов восстановления в металлическом виде конденсируют пары в аппарате при более высоком давлении.
Восстановление оксидов при образовании растворов
В реальных условиях производства металл и оксид, из которого он восстанавливается, и оксид восстановителя образуют между собой твердые или жидкие растворы. При этом активности веществ уже не будут равны 1 и для реакции (МеО) + СО = Me + CO2 константу равновесия следует записать как
K = a [Me]PCO2/a(MeO) PCO = a [MeO]*%CO'2*/ a (MeO)%CO'
По правилу фаз число степеней свободы в этом случае будет равно двум, если число фаз равно трем (газ, металл, раствор оксида), например в шлаке: С = 3 - 3 + 2 = 2.
Так как превращение протекает без изменения объема, то можно исключить из параметров, влияющих на равновесие, давление. Таким образом равновесное состояние будет определяться температурой или концентрацией. Равновесный состав газа при постоянной температуре зависит от состава и концентрации раствора. При образовании насыщенного раствора, когда выделяется свободная фаза МеО, а MeO = 1, число независимых переменных, т.е. степеней свободы, уменьшается на единицу и состав газа так же, как и в отсутствии раствора, определяется только температурой.
Если принять, что a [Ме] = 1, а а Ме0 = γ MeO*NMeO коэффициент активности и мольная доля (концентрация МеО) в растворе, а в случае отсутствия раствора К = % СO2/% СО, то
%CO2/%CO = %CO'2/%CO'γ(MeO)N(MeO) и %СО'2/%СО = %СО2/%СО(γ(MeO)N(MeO)
Из соотношений следует, что при образовании ненасыщенного раствора равновесная газовая фаза содержит больше СО и меньше СO2, чем при восстановлении с участием чистых фаз. Чем ниже концентрация МеО в растворе, т.е. чем меньше NMeO, тем больше должно быть содержание СО, т.е. тем труднее восстанавливать оксид, что объясняется понижением упругости диссоциации оксида и повышением его прочности при понижении его концентрации в растворе. На диаграмме рис. 39 показано, как влияет образование раствора на___________________________
* Состав газовой фазы при образовании раствора.
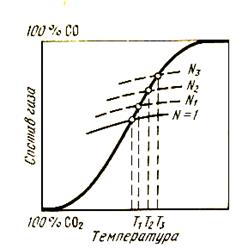 |
Рисунок 39 - Равновесный состав газа и температуры равновесия в реакциях косвенного и прямого восстановления при образовании растворов N3<N2< N1< 1
температуру начала восстановления. С понижением концентрации оксида кривые равновесия косвенного воccтановления смещаются вверх, а температура начала восстановления оксидом углерода соответственно возрастает. Рассмотрим реакцию прямого восстановления:
(МеО) + С = Me + СО.
По правилу фаз С = 3 - 4 + 2 = 1 (имеем четыре фазы - углерод, газ, 0раствор, металл, одну степень свободы), т.е. температура равновесия становится функцией только концентрации МеО. Каждой концентрации МеО в растворе соответствует температура начала восстановления твердым углеродом. Чем ниже концентрация оксида в растворе, тем труднее его восстанавливать и твердым углеродом. Рассмотрим случай, когда восстанавливаемый металл переходит ' в раствор. Этот случай характерен для восстановления оксидов при выплавке стали или чугуна, когда в восстановительной атмосфере находятся металл и шлак.
Для косвенного восстановления марганца уравнение реакции имеет вид:.
(MnO) + CO = [Mn] + CО2. (121)
По правилу фаз: С = 3 - 3 + 2 = 2 (имеем три фазы: шлак, металл и газ). Равновесный состав газа является функцией температуры и концентрации Мn в металле либо МnО в шлаке. Константа равновесия реакции (121)
K121=PCO2 a [Mn]/PCO a MnO = %CO'2 a [Mn]/%CO' a (MnO)=%CO'2 f *[Mn][%Mn]/%CO'γ(MnO)N(MnO) ;
%CO'2/%CO' =%CO2/%CO=γ[Mn]*N(MnO)/ f [Mn][%Mn]
* f — коэффициент активности в растворах, близких к разбавленным; у — коэффициент активности в растворах, близких к совершенным.
Из соотношения следует, что:
1) чем ниже концентрация МnО в шлаке, тем газ должен быть
больше обогащен СО, т.е. обладать более высоким восстановительным потенциалом;
2) чем ниже концентрация Мn в металле, тем меньше должно
содержаться СО в газовой фазе, т.е. восстановление марганца из
оксида должно протекать легче. Во всяком случае восстановление
облегчается, если образующийся металл переходит в раствор,
например в железо, т.е. восстановление протекает легче при образовании
сплава марганца с железом, чем чистого марганца. Это
связано с увеличением упругости диссоциации и уменьшением
прочности оксида. Кривые косвенного восстановления находятся в
области более низких концентраций СО.
При прямом восстановлении по точке пересечения с кривой газификации твердого углерода видно, что температура начала восстановления твердым углеродом понижается. Если для восстановления МnО с образованием чистого марганца необходим нагрев не менее чем до 1420 °С, то в присутствии растворителя - железа- восстановление марганца начинается при более низких температурах. Таким образом, понижение концентрации оксида в шлаке затрудняет восстановление, а образование раствора восстанавливаемого металла в другом металле облегчает восстановление.
Восстановление оксидов железа оксидом углерода (II)
Pеакции восстановления оксидов железа записываются следующими уравнениями:
3Fe203 + СО = 2Fe3O4 + СO2, ΔН°298 = -52,13 кДж. (122)
Fe304 + CO = 3FeO + CO2, ΔН°298 =+35,38 кДж. (123)
FeO + СО = Fe + СO2, ΔН°298 = -13,16 кДж. (124)
ниже 570 °С l/4Fe3O4 + СО = 3/4Fe + СO2, ΔН°298 = -21,03 кДж. (125)
Константы равновесия этих реакций, если считать, что оксиды железа и железо участвуют в виде чистых веществ, имеют вид: К = % СО2/% СО. В табл. 9 приведены температурные зависимости ΔG и lgK.
Реакции (122), (124), (125) являются экзотермическими, реакция (123) - эндотермической. Реакция (122) является практически необратимой, ее равновесие сильно смещено в сторону восстановления Fe2O3 оксидом углерода, а реакции (123) - (125) являются обратимыми и могут протекать в прямом и в обратном направлениях.
Применение правил фаз показывает, что для всех реакций число степеней свободы равно 1:С = 3-3 + 1 = 1. Так как процессы протекают без изменения объема, то можно пренебречь влиянием давления.
Таблица 9 - Температурные зависимости ΔG° и lgK реакций восстановления оксидов железа СО
| Реакция | ΔG°, Дж | lgK |
| 3Fe2O3 + CO = 2Fe3O4 + CO2 | - 52130 – 41,0T | 2722/T +2,136 |
| Fe3O4 + CO = 3 FeO + CO2 | 35380 – 20,17T | - 1847/T + 1,05 |
| FeO + CO = Fe + CO2 | - 13160 + 17,21T | 687/T – 0,90 |
| 1/4Fe3O4 + CO = 3/4Fe + CO2 | 21030 + 2,96T | 1098/T – 0,155 |
Только температура определяет равновесный состав газовой фазы. Из трех оксидов железа при t > 570 "С наиболее устойчивым является FeO, наименее прочным - Fe2О3.
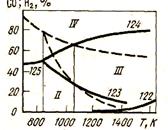 |
На рис. 40 приведена диаграмма восстановления оксидов железа СО. Линии диаграммы показывают зависимость равновесного состава газа от температуры для реакции восстановления оксидов железа.
Рисунок 40 - Диаграмма восстановления оксидов железа СО и Н2; пунктирные линии — восстановление водородом
Нумерация линий соответствует реакциям, приведенным в табл. 9. Линии, соответствующие реакциям (122), (124), (125), - восходящие для экзотермических реакций восстановления, а линия, соответствующая реакции (123), - нисходящая, так как эта реакция эндотермическая. При 570 °С оксиды FeO и Fe3О4 равнопрочны, поэтому равновесные газовые смеси имеют при этой температуре одинаковый состав. Кривые пересекаются в одной точке. Области, заключенные между кривыми на рис. 40, соответствуют областям устойчивого существования следующих фаз: I - Fe2О3; II - Fe3О4; III - FeO; IV - металлического железа.
Рассмотрим с помощью диаграммы процессы, происходящие в системе при изменении состава газа при постоянной температуре или при изменении температуры при постоянном составе газовой фазы.
Температура 1000 °С. При содержании в газовой фазе смеси до 20 % СО из всех оксидов железа устойчивым при этих условиях является Fe3О4.
При повышении выше 20 % количество СО в газе Fe304 превра-
- щается в FeO, которое существует устойчиво вплоть примерно до 70 % СО; при более высокой концентрации СО устойчивым будет металлическое железо. Таким образом, чтобы при этой температуре обеспечить восстановление оксидов до металлического железа, необходимо иметь в газовой фазе > 70 % СО.
Рассмотрим газ, в котором имеется 30 % СО. До 800 оС устойчивым является магнетит, а при t > 800 оС - FeO.
Восстановление оксидов железа водородом
Восстановление оксидов железа водородом протекает по следующим реакциям при t > 570 °С:
3Fe2О3 + Н2 = 2Fe3О4 + H2О, ΔН°298 = -15,5 кДж. (126)
Fe3О4 + Н2 = ЗFеО + Н2O, ΔН°298 = 71,9 кДж. (127)
FeO + Н2 = Fe + Н2O, ΔН°298 = 23,4 кДж (128)
и при t < 570 oС
l/4Fe3O4 + H2 = 3/4Fe + H2O, ΔН°298 = 35,5 кДж. (129)
Константы равновесия этих реакций запишем следующим образом: Kр = PH2O/PH. Реакции (127), (128), (129) - эндотермические, а реакция (126) - экзотермическая. Кривые, соответствующие равновесиям реакций (126) - (129), нанесены пунктиром на графике рис. 40. Кривые, соответствующие реакциям (127), (128), (129), - нисходящие. При t = 570 °С, так же как и для восстановления оксидов железа СО, кривые пересекаются в одной точке, так как оксиды FeO и Fe3O4 равнопрочны. Как было показано выше, при
Таблица 10- Зависимости ΔGо и lgK от температуры для реакций восстановления оксидов железа водородом
| Реакция | ΔGо, Дж | lgK |
| 3Fe2O3 + H2 = 2Fe3O4 + H2O | - 15547 – 74,46T | 812/T + 3,89 |
| Fe3O4 + H2 = 3FeO + H2O | 71940 – 73,62T | - 3757/T + 3,85 |
| FeO + H2 = Fe + H2O | 23430 – 16,16T | - 1223/T + 0,845 |
| 1/4Fe3O4 + H2 = 3/4 Fe + H2O | 35550 – 30,2T | - 1856/T = 1,58 |
820 °С СО и Н2 обладают одинаковым сродством к кислороду, поэтому кривые соответствующих реакций восстановления пересекаются при 820 оС.
Из диаграммы видно, что при температурах, превышающих 820 оС, для восстановления железа Fe3О4 до FeO концентрация водорода в газовой смеси может быть ниже, чем СО, так как при высоких температурах водород обладает более высоким сродством к кислороду, чем СО. При температурах ниже 820 °С оксиды подчиняются обратным соотношениям.
Температурные зависимости ΔG и lgK приведены в табл. 10.
Влияние фазовых превращений на равновесие реакций восстановления
При высоких температурах происходят полиморфные превращения металлов или оксидов. Например, железо переходит из α-Fe в| β-Fe, из β-Fe в γ-Fe и т.д, твердые вещества расплавляются. В табл. 11 приведены характеристики этих изменений.
Таблица 11- Фазовые переходы в системе железо — кислород
| Переход | Температура перехода, оС | Теплота перехода, кДж/моль |
| α-Fe →β-Fe | 2,89 | |
| β-Fe→γ-Fe | 1,45 | |
| γ-Fe→δFe | 0,92 | |
| δFe→Feж | 15,15 | |
| FeOт→FeOж | 36,00 |
При термодинамических расчетах реакций восстановления, протекающих при повышенных температурах, необходимо учитывать теплоты фазовых переходов. Так, для термодинамического расчета реакции восстановления FeO при температуре выше 1540°С необходимо учитывать все вышеуказанные теплоты. Если для реакции
FeOT + СО = α-Fe +CО2, ΔН°298 = - 13,16 кДж/моль;
α-Fe = β-Fe, ΔН°298 = +2,89 кДж/моль;
β-Fe = γ-Fe, ΔН°298 = +1,45 кДж/моль;
γ-Fe = δ-Fe, ΔН°298 = +0,92 кДж/моль;
δ-Fe = Fеж, ΔН°298 = +15,15 кДж/моль;
FeOT = FеОж, ΔН°298 = 36,00 кДж/моль;
то
FеОж + СО = Fеж + С02, ΔН°298 = -28,75 кДж/моль.
Равновесное содержание СО в газовой фазе при повышении температуры будет интенсивно возрастать и чем больше тепла, тем меньше будет концентрация СO2 в газовой фазе, поскольку 
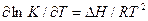 < 0.
< 0.
Восстановление оксидов железа участием твердого углерода
Как и при восстановлении других оксидов, восстановление оксидов железа твердым углеродом путем непосредственного контакт кусков оксида и кусков углерода - кокса, угля, графита - имеет весьма ограниченный характер из-за несовершенства контактов между кускообразными материалами. Основной объем восстановлена осуществляется с помощью газовой фазы через следующие стадии:
FeO + СО = Fe + CО2 (124
С + СО2 = 2СО. (12)
FeO + C = CO + Fe. (130)
Для магнетита имеет место суммарная реакция:
Fe3O4 + С = 3FeO + СО. (131)
Эти две реакции и представляют процесс прямого восстановлена оксидов железа углеродом, причем первая из них может протекай только при температурах выше 750 °С.
На рис. 41 представлена диаграмма восстановления оксидов железа СО, на которую нанесены кривые равновесия реакции газификации углерода. Кривые газификации нанесены для различны: давлений газовой фазы. Точки пересечения кривых отвечают уcловиям существования четырех фаз в указанных системах:
a) Fe3O4 – Fe – C – (CO + CO2); б) Fe3O4 – FeO – C – (CO +CO2);
в) FeO – Fe – C – (CO + CO2).
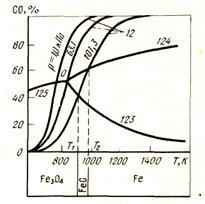 |
Рисунок 41 - Совмещенная диаграмм косвенного и прямого восстановления оксидов железа СО и углеродом.
При давлении 101,3 кПа кривые пересекаются при температурах 650 и 700 оС. При t < 650 °С в присутствии твердого углерода в данной системе должен существовать только Fe3О4, от 650 до 700 оС устойчивым является вюстит и только при температурах выше 700 °С происходит восстановление до металлического железа.
Восстановление оксидов железа углеродом протекает со следующими тепловыми эффектами:
3Fe2О3 + С = 2Fе3O4 + СО; ΔНo298= 118,82 кДж.
Fe3O4 + С = 3FeO + CO; ΔНo298= 209,26 кДж.
FeO + С = Fe + СО; ΔНo298= 156,5 кДж.
1/4Fе3O4 + С = 3/4Fе + СО; ΔНo298= 169,7 кДж.
Поскольку реакции эндотермические, то повышение температуры благоприятствует их протеканию, равновесие смещается в правую сторону, таким же образом действует и понижение давления.
 2015-06-24
2015-06-24 9416
9416