Увеличение растворимости малорастворимых соединений часто связано с образованием комплексов. Во многих случаях осаждаемые ионы способны взаимодействовать с различными лигандами, в результате чего они влияют на состояние равновесия между осадком и раствором. Так, ионы винной кислоты и других оксикислот мешают осаждению железа в виде гидроксида. Растворимость сульфата свинца в присутствии Рb(NО3)2 увеличивается в результате образования комплексных катионов [Pb2SO4]2+, [Pb3(SO4)2]2+ и др. При осаждении ионов серебра избытком хлороводородной кислоты или хлорида натрия часть осадка хлорида серебра переходит в раствор в виде комплексных анионов [AgCl2]-или [AgC13]2-.
Сдвиг состояния равновесия между осадком и раствором в сторону растворения осадка зависит от произведения растворимости осадка, устойчивости комплекса, концентрации лиганда, кислотности раствора и других условий.
С помощью лигандов можно связать различные ионы, которые мешают анализу, методом осаждения или другими методами. По существу этот процесс соответствует разделению без фильтрования, промывания и т. д., которые требуют много времени.
Расчеты растворимости осадков при образовании комплексов связаны с некоторыми затруднениями. Обусловлено это тем, что для многих комплексных соединений пока не установлены константы нестойкости или устойчивости. Кроме того, комплексные ионы, аналогично многоосновным кислотам, образуются и диссоциируют ступенчато. Состояние равновесия между отдельными формами комплексных групп зависит от концентрации лиганда и кислотности раствора.
ПРИМЕР 3.10 Рассчитать растворимость хлорида серебра в 1М растворе NH3 при условии, что после достижения равновесия концентрация избытка аммиака [NH3] составила 0,1моль/л.
Решение: Растворимость хлорида серебра в растворе аммиака связана с образованием аммиачного комплекса:
AgCl + 2NH3 ↔[Ag(NH3)2]Cl.
Это соединение представляет собой сильный электролит и диссоциирует на ионы [Ag(NH3)2]+ и С1-. Таким образом, комплексным является катион [Ag(NH3)2]+, который очень слабо диссоциирует. Поэтому растворимость в этом случае связана с взаимодействием ионов серебра с аммиаком по уравнению:
Ag+ + 2NH3 ↔[Ag(NH3)2]+.
Константа устойчивости комплекса имеет вид:
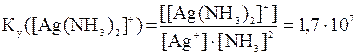 .
.
Произведение растворимости хлорида серебра:
ПPAgCI = [Ag+][С1-] = 1∙10-10.
Уравнение реакции между хлоридом серебра и аммиаком можно записать следующим образом:
AgCl + 2NH3 ↔[Ag(NH3)2]+ + CI-.
Константа равновесия этой реакции
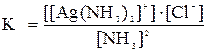 .
.
Если это выражение умножить и поделить на концентрацию ионов серебра [Ag+] и подставить соответствующие значения, то
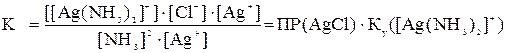 .
.
К=1,7∙107∙10-10=1,7∙10-3
Состояние равновесия реакции смещается вправо тем больше, чем больше растворимость осадка и чем меньше константа диссоциации комплекса, т. е. чем больше его устойчивость.
При растворении осадка AgCl в растворе NH3 количества ионов С1- и [Ag(NH3)2]+ будут равны, т.е. [C1-] = [Ag(NH3)2]+.
Тогда можно записать:
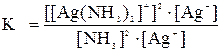
Отсюда, 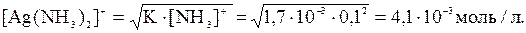
Следовательно, растворимость AgCl, в воде равна 10-5М, а в 1М растворе аммиака увеличивается до 3,7∙10-3 М, т.е. осадок практически полностью переходит в раствор.
3.5. ДРОБНОЕ ОСАЖДЕНИЕ
Нередко прибавляемый реагент образует малорастворимое соединение не с одним, а с двумя или несколькими ионами, находящимися в растворе. Используя правило произведения растворимости, можно понять, как происходит осаждение ионов в подобных случаях.
Допустим, что в растворе одновременно присутствуют катионы Ca2+ и Ba2+, их концентрации равны 10-1 моль/л. При постепенном прибавлении к этой смеси раствора оксалата аммония (NH4)2C2O4 возможно течение двух реакций:
Са2++С2О42-=СаС2О4↓ ПРСаС2О4=[Са2+]∙[ С2О42-]=2,6∙10-9.
Ва2++С2О42-=ВаС2О4↓ ПРВаС2О4=[Ва2+]∙[ С2О42-]=1,6∙10-7.
Первым выпадает в осадок то соединение, для которого раньше будет достигнута (и превышена) величина произведения растворимости.
Исходя из значений ПР, можно вычислить, какие концентрации иона C2O42- необходимы для начала осаждения оксалата кальция и бария:
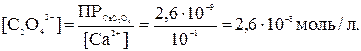
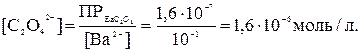
Из приведенных расчетов видно, что для осаждения оксалата кальция требуется значительно меньшая концентрация оксалат-иона (2,6∙10-8 моль/л), чем для оксалата бария (1,6∙10-6 моль/л).
Следовательно, из смеси будет первым осаждаться оксалат кальция, для которого произведение растворимости достигается раньше.
Таким образом, осаждение ионов из их смеси происходит в той последовательности, в какой достигаются произведения растворимости малорастворимых электролитов, образующихся при действии того или иного реактива, т.е. первым выпадет в осадок соединение с меньшим значением произведения растворимости. Такое последовательное осаждение называется фракционированным (или дробным).
Последовательность выпадения осадков зависит не только от величины ПР, но и от концентрации соответствующих ионов в растворе. Например, увеличив концентрацию ионов Вa2+ в 100 раз и больше по отношению к концентрации ионов Ca2+, удается вызвать обратную последовательность осаждения оксалатов бария и кальция, т. е. первым выпадает осадок BaC2O4.
Дробное осаждение используют достаточно часто в качественном химическом анализе, осадочной хроматографии и т. д.
3.6. Превращение одних малорастворимых
соединений в другие
В аналитической химии часто приходится иметь дело с реакциями, в которых одно малорастворимое соединение переводят в другое, еще менее растворимое в данных условиях. Например, осадок SrSO4 (ПР=3,2·10-7) легко превращается в SrCO3 (ПР = 1,1∙10-10) при действии избытка раствора Na2CO3 на осадок SrSO4.
Это имеет большое практическое значение, т. к. SrSO4 не растворяется в кислотах, а SrCO3 – растворим. Поэтому, чтобы перевести SrSO4 в раствор, его сначала превращают в карбонат, а затем растворяют в кислотах.
Если сравнить произведения растворимости BaSO4 (ПР=1,1·10-10) и BaCO3 (ПР=5,1·10-9), может показаться, что перевести сульфат бария в карбонат нельзя. Однако это не так. Осадок BaCO3 образуется всегда, когда произведение растворимости его окажется превышенным, т. е. 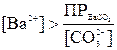 .
.
Превращение BaSO4 в BaCO3 должно происходить при условии: 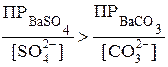 , т. е.
, т. е. 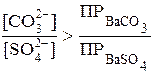 ,
,
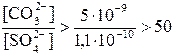
Таким образом, чтобы превращение BaSO4 в BaCO3 происходило, надо, чтобы [CO32- ] в растворе превышала [SO42-] более, чем в 50 раз.
На практике для более полного перевода осадка осуществляют многократное действие свежей порцией раствора Na2CO3 на осадок, сливая при этом жидкость с осадка.
Процессы превращения одних малорастворимых соединений в другие могут быть с успехом использованы для разделения ионов, особенно при их дробном обнаружении.
 2015-06-24
2015-06-24 9217
9217
